Определение химических показателей, характеризующих
качественное состояние белка рыбы
5. Открытие и определение летучих азотистых оснований
Под летучими азотистыми основаниями понимают аммиак и моноамины – метиламин, ди- и триметиламин. Источниками их образования может быть как автолиз мяса рыбы, так и порча рыбы в результате жизнедеятельности протеолитической микрофлоры.
Установлено несколько типов реакций, характеризующих распад аминокислот с образованием аммиака и аминов:
- процесс дезаминирования с образованием простых кислот и аммиака:
RCHNH2COOH + H2 = RCH2COOH + NH3
- процесс декарбоксилирования, в котором после отщипления диоксида углерода или углекислоты образуются моноамины:
RCHNH2COOH = RCH2NH2 + CO2
RCHNH2COOH + H2 = RCH2NH2 + HCOOH
- процессы дезаминирования и декарбоксилирования
RCHNH2COOH + H2 = RCH3 + NH3 + CO2
5.1. Определение летучих сернистых соединений, в частности сероводорода (Н2S) (стандартный метод).
Летучие сернистые соединения включают сероводород и меркаптаны (метилмеркаптан CH3SH, этилмеркаптан C2H5SH, этилсульфид C2H5S и др.); они образуются в процессе порчи рыбы в результате автолитического и микробиологического расщипления белковых веществ, содержащих до 1% серы.
Качественными методами определяется свободный сероводород. Метод основан на взаимодействии сероводорода, образующегося при порче рыбы, со свинцовой солью с появлением темного окрашивания вследствие образования сернистого свинца.
Раствор свинцовой соли готовят путем прибавления 30%-го раствора гидроксида натрия к 4%-му раствору уксуснокислого свинца до растворения образовавшегося вначале осадка гидроксида свинца.
Проведение испытания:
15-25 г исследуемого фарша помещают рыхлым слоем в бюксу вместимостью 40-50 мл. На полоску фильтровальной бумаги наносят 3-4 капли раствора свинцовой соли. Полоску закрепляют, зажимая ее между крышкой и корпусом бюксы, на расстоянии около 1 см над фаршем, обращая ее к фаршу той стороной, на которую наносился раствор соли.
Параллельно проводят контрольное определение без навески фарша.
Бюксы оставляют стоять при комнатной температуре. По истечении 15 минут полоски бумаги снимают и сравнивают окраску. Побурение или почернение бумажки указывает на наличие свободного сероводорода в исследуемом образце.
Интенсивность реакции обозначают следующим образом:
| _ | отрицательная – капли окрашены одинаково; |
| + _ | наблюдаются следы окрашивания капли; |
| + | слабоположительная – бурое окрашивание по краям капли; |
| + + | положительная – бурое окрашивание всей капли, более интенсивное по краям; |
| + + + | резко положительная – интенсивное темно-бурое окрашивание всей капли. |
5.2. Определение аммиака по Эберу (стандартный метод).
Метод основан на взаимодействии аммиака, образующегося при порче рыбы, с соляной кислотой и появлении при этом облачка хлористого аммония.
Смесь Эбера состоит из одной части 25% HCL (ρ=1,12 г/см3), трех частей 96%-го этилового спирта и одной части серного эфира.
Проведение испытания:
В широкую пробирку наливают 2-3 мл смеси Эбера, закрывают пробкой и встряхивают 2-3 раза. Затем вынимают пробку и сразу же закрывают пробирку другой пробкой, через которую продета тонкая стеклянная палочка с загнутым концом. На конце палочки прикрепляют кусочек мышечной ткани исследуемой рыбы. Исследуемый объект должен иметь температуру, наиболее близкую к температуре воздуха лаборатории. Мясо вводят в пробирку, не касаясь стенок пробирки, и располагают его на расстоянии 1-2 см от уровня жидкости.
При наличии азота аммиака и других летучих оснований свыше 15 мг% через несколько секунд образуется белое облачко хлористого аммония, опускающееся вниз или обволакивающее мясо.
Интенсивность реакции обозначают следующим образом:
| - | отрицательная – облачко отсутствует; |
| + | слабоположительная – быстро исчезающее расплывчатое облако; |
| + + | положительная – устойчивое облачко, появляющееся через несколько секунд после внесения мяса в пробирку; |
| + + + | резко положительная – облачко появляется сразу после внесения мяса в пробирку. |
Наиболее отчетливое облакообразование наблюдается при температуре мяса рыбы 18-200С и относительной влажности воздуха более 75%, при более низкой температуре картина получается менее отчетливой.
5.3. Определение азота летучих оснований
Свободные и связанные летучие основания отгоняют паром.
Проведение испытания:
Вначале готовят 10%-ю вытяжку из мяса рыбы, для чего 25 г фарша рыбы, взвешенные с точностью 0,01 г, переносят безаммиачной дистиллированной водой в мерную колбу на 250 мл, заполняя ее на 2/3 объема. Колбу настаивают на шуттель-аппарате в течение 30 мин. Затем дистиллированной водой доводят объем содержимого колбы до метки, хорошо перемешивают и фильтруют через ватный фильтр в коническую колбу на 250 мл.
25 мл полученного фильтрата переносят пипеткой в колбу Кьельдаля, туда же добавляют 15 мл 5%-ного магнезиального молока (или 1 г сухого MgO). В приемник (коническая колба на 100 мл) наливают 10 мл 0,1н раствора H2SO4 и 2-3 капли смешанного (двойного) индикатора (можно также использовать индикатор метиловый красный). Собирают прибор (см. рис. 1) и ведут отгонку до отрицательной реакции на азот по лакмусу.
После окончания отгонки избыток серной кислоты оттитровывают 0,1 н раствором NaOH до перехода окраски от фиолетовой к бледно-зеленой (при использовании метилового красного – от красной к светло-желтой).
Оттитрованную жидкость используют для определения триметиламина (п. 5.4).
Параллельно, в тех же условиях, проводят контрольный опыт, используя вместо фильтрата дистиллированную воду.
Содержание азота летучих оснований (АЛО) в мг на 100 г продукта определяют по формуле:
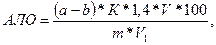
где а – количество щелочи, пошедшей на титрование в контрольном опыте, мл;
b – количество щелочи, пошедшей на титрование в рабочем опыте, мл;
К – поправочный коэффициент для 0,1 н раствора щелочи;
1,4 – количество азота, эквивалентное 1 мл точно 0,1 н раствора щелочи;
V – объем колбы разведения, мл;
V1 – объем фильтрата, взятого для анализа, мл;
m – масса навески, г.
Вычисление проводят с точностью до 0,1 мг на 100 г.
5.4. Определение триметиламина по методу Гольмова.
К оттитрованной жидкости (п. 5.3) прибавляют 10 капель индикатора бромтимолблау-фенолрот (по 0,2 г каждого индикатора растворяют в 100 мл 60%-го этилового спирта) и 20 мл формалина, предварительно нейтрализованного 0,1 н раствором гидроксида натрия в присутствии того же индикатора. Выделившуюся при этом кислоту снова оттитровывают щелочью до перехода окраски от желто-зеленого цвета к фиолетовому.
Количество азота аммиака (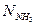 ) в мг на 100 г определяют по формуле:
) в мг на 100 г определяют по формуле:
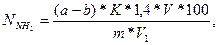
где а – количество щелочи, пошедшей на титрование после добавления формалина в контрольном опыте, мл;
b – количество щелочи, пошедшей на титрование после добавления формалина в рабочем опыте, мл.
Остальные показатели имеют те же значения, что и в п. 5.3.
Количество триметиламина (ТМА) в мг на 100 г определяют по разности между количеством азота летучих оснований (АЛО) и азотом аммиака 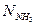 :
:
ТМА = АЛО - 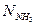
5.5. Определение небелкового азота.
К группе небелковых азотистых веществ (НБА) относятся промежуточные и конечные продукты обмена белков, а также низкомолекулярные соединения, содержащие азот. В мышцах рыб небелковые азотистые вещества растворены в клеточной плазме и межклеточной жидкости. НБА составляет в мясе костистых рыб 9-14%, хрящевых – до 40% общего количества азота. Содержание НБА зависит от вида, возраста, пола, физиологического состояния рыбы; их содержание увеличивается по мере порчи мяса рыбы.
Для определения небелкового азота к исследуемому материалу прибавляют соответствующий реактив, осаждающий белок. Выпавший осадок белка отфильтровывают, затем производят определение азота в фильтрате, который соответствует небелковому азоту. Зная содержание общего азота и НБА в исследуемом материале можно по разности между ними определить количество белкового азота.
5.5.1. Определение небелкового азота с отделением белков трихлоруксусной кислотой (ССl3COOH).
Трихлоруксусная кислота (ТХУК) по сравнению с другими осадителями белков оставляет в растворе небольшое количество продуктов распада белков, осаждая одновременно с белками лишь часть пептонов.
Проведение испытания:
Навеску фарша массой 20 г, взвешенную с точностью 0,01 г, растирают в ступке со 100 мл дистиллированной воды, затем переносят в мерную колбу емкостью 200 мл, заполняя ее на 2/3 объема, настаивают 30 мин на шуттель-аппарате, после чего доводят дистиллированной водой до метки, перемешивают и фильтруют через ватный фильтр. В коническую колбу на 100 мл отбирают пипеткой 25 мл полученного фильтрата и, взбалтывая, приливают небольшими порциями 25 мл 20%-го раствора трихлоруксусной кислоты. Через 15 минут раствор фильтруют через складчатый бумажный фильтр.
В колбу Къельдаля емкостью 250-300 мл пипеткой вносят 20 мл фильтрата, 15 мл концентрированной серной кислоты, добавляют в качестве катализатора 0,2-0,3 г сульфата меди и определяют азот способом, описанным в п. 3.3.1, только в приемную колбу наливают 25 мл 0,02 н. раствора серной кислоты и титрование проводят 0,02 н. раствором гидроксида натрия..
Параллельно проводят контрольный опыт.
Содержание небелкового азота (НБА) в мг% определяют по формуле:
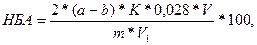
где 2 – коэффициент, учитывающий разведение вытяжки трихлоруксусной кислотой;
а – количество щелочи, пошедшей на титрование в контрольном опыте, мл;
b – количество щелочи, пошедшей на титрование в рабочем опыте, мл;
К – поправочный коэффициент для 0,02 н раствора щелочи;
0,028 – количество азота, эквивалентное 1 мл точно 0,02 н раствора щелочи, мг;
V – объем колбы разведения, мл;
V1 – объем фильтрата, взятый для минерализации, мл.
m – масса навески, г.
Вычисление проводят с точностью до 0,1 мг/100 г.
5.6. Определение азота концевых аминогрупп методом формольного титрования (по Черногорцеву).
Данный метод позволяет определить количество азота в аминогруппах, принадлежащих продуктам гидролитического расщепления белков (аминокислоты, короткие пептиды, полипептиды). Определение основано на способности формалина вступать во взаимодействие со свободными аминогруппами продуктов гидролитического расщепления белков. При этом образуются сильные метиленаминокислоты, которые оттитровывают щелочью.

 R-CH-NH2 + СH2O R-CH-N=СH2 + H2O
R-CH-NH2 + СH2O R-CH-N=СH2 + H2O
 |
COOH COOH
Проведение испытания:
Навеску фарша массой 20 г, взвешенную с точностью до 0,01 г, растирают в ступке со 100 мл дистиллированной воды, затем переносят в мерную колбу емкостью 200 мл и настаивают в течение 30 мин на шуттель-аппарате. Затем колбу прогревают в течение 15 минут на кипящей водяной бане до полной коагуляции белка, содержимое колбы охлаждают, доводят дистиллированной водой до метки, перемешивают и фильтруют через ватный фильтр.
Затем берут три конические колбы емкостью 100 мл.
В первую колбу вносят пипеткой 25 мл фильтрата, добавляют 10 мл 40%-ного нейтрального раствора формалина, 1 мл индикатора № 2 и титруют 0,1 н раствором NaOH до появления розовой окраски.
Во вторую колбу вносят пипеткой 25 мл фильтрата, добавляют 0,5 мл индикатора № 1 и 0,8 мл индикатора № 2, после чего титруют 0,1 н раствором NaOH до появления зеленой окраски.
В третью колбу вносят пипеткой 25 мл дистиллированной воды, 10 мл 40%-го нейтрального раствора формалина, 1 мл индикатора № 2 и титруют 0,1 н раствором NaOH до появления розовой окраски.
Содержание формольно-титруемого азота (ФТА) в мг на 100 г продукта определяют по формуле:
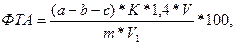
где а – количество щелочи, пошедшей на титрование первой колбы, мл;
b – количество щелочи, пошедшей на титрование второй колбы, мл;
с – количество щелочи, пошедшей на титрование третьей колбы, мл;
К – поправочный коэффициент для 0,1 н раствора щелочи;
1,4 – количество азота, эквивалентное 1 мл точно 0,1 н раствора щелочи, мг;
V – объем колбы разведения, мл;
V1 – объем фильтрата, взятый на титрование;
m – масса навески, г.
Вычисление проводят с точностью до 0,1 мг/100 г.
5.7. Определение тирозина (метод Ансона)
Определение тирозина производится колориметрическим методом, основанном на взаимодействии тирозина с реактивом Фолина в щелочной среде, дающем синее окрашивание.
Навеску фарша массой 25 г, взвешенную с точностью до 0,01 г, переносят в мерную колбу емкостью 250 мл с помощью дистиллированной воды, заполняя ее на 2/3 объема, и настаивают в течение 30 мин на шуттель-аппарате. Полученную вытяжку выдерживают в кипящей водяной бане в течение 15 минут до полной коагуляции белка, охлаждают до комнатной температуры, доводят до метки дистиллированной водой и фильтруют через плотный бумажный фильтр.
К 1 мл фильтрата, взятому в мерную колбу на 50 мл, приливают 10 мл 0,5 н раствора NaОH, 3 мл свежеприготовленного “рабочего” реактива Фолина, раствор в колбе доводят до метки дистиллированной водой и хорошо перемешивают. Колбу оставляют на 10 минут для развития окрашивания. Затем измеряют оптическую плотность на фотоэлектроколориметре при длине волны 600 нм, используя кювету с толщиной слоя 10 мм. Колориметрирование ведут против контрольного раствора, приготовленного аналогично, но вместо 1 мл фильтрата берут 1 мл дистиллированной воды.
Через оптическую плотность по предварительно построенному калибровочному графику находят количество тирозина в миллиграммах с последующим пересчетом в миллиграмм-проценты.
Калибровочный график строят по стандартному раствору тирозина: 0,01 г чистого тирозина растворяют в 100 мл 0,2 н. раствора соляной кислоты. 1 мл полученного стандартного раствора содержит 0,1 мг тирозина. В мерные колбы на 50 мл берут 1, 2, 3, 4, 5 и т.д. мл стандартного раствора тирозина, в каждую добавляют по 10 мл 0,5 н. раствора NaOH, встряхивают и затем вносят по 3 мл «рабочего» реактива Фолина, раствор в колбе доводят до метки дистиллированной водой и хорошо перемешивают. Колбу оставляют на 10 минут для развития окрашивания. Затем измеряют оптическую плотность на фотоэлектроколориметре при длине волны 600 нм, используя кювету с толщиной слоя 10 мм. Колориметрирование ведут против контрольного раствора, приготовленного аналогично, но вместо раствора тирозина берут дистиллированную воду.
На оси абсцисс откладывают содержание тирозина – С (в миллиграммах), а на оси ординат – оптическую плотность раствора – D600.
Приготовление «рабочего» реактива Фолина.
Реактив Фолина – это смесь фосфорномолибденовой и фосфорновольфрамовой кислот. В колбу емкостью 200 мл вносят 10 г Na2WO4*2H2O, 2,5 г Na2MoO4, 70 мл дистиллированной воды, 5 мл 85%-ной H3PO4 и 10 мл концентрированной HCl. Смесь кипятят с обратным холодильником на песчаной бане в течение 10 часов, затем прибавляют 15 г LiSO4, 5 мл дистиллированной воды и несколько капель брома. Для удаления избытка брома раствор кипятят без холодильника под вытяжкой еще 15 минут. После охлаждения раствор доводят до 100 мл дистиллированной водой, фильтруют и хранят в склянке из темного стекла. Полученный раствор называется «стандартным».
«Рабочий» реактив Фолина готовят путем разведения «стандартного» раствора дистиллированной водой в соотношении 1:2 в день проведения анализа.
5.8. Определение рН.
Определение рН мышечной ткани является наиболее быстрым методом установления качества рыбы. Значение рН хорошо коррелирует с продолжительностью хранения мороженой рыбы. При порче рыбы вследствие образования аммиака наблюдается сдвиг рН в щелочную сторону.
Определение рН в рыбных продуктах проводится следующими способами:
а) непосредственно в мышечной ткани рыбы;
б) в рыбном фарше, полученном путем измельчения в мясорубке;
в) в смеси фарша с водой;
г) в водной вытяжке из исследуемого продукта.
Водную вытяжку готовят следующим образом: навеску фарша рыбы (рыбного продукта) разводят дистиллированной водой в соотношении 1:10, настаивают 30 мин на шуттель-аппарате и фильтруют через складчатый бумажный фильтр. Для измерения рН чаще всего применяют приборы, называемые рН-метрами. Измерение рН проводят не менее 3-х раз и значение берут как среднее арифметическое. Расхождение между параллельными определениями не должно быть более 0,1. Одновременно делают поправку с учетом рН дистиллированной воды, используемой при определении.
5.9. Определение водоудерживающей способности.
Водоудерживающая способность (ВУС) характеризует лиофильные свойства мышечной ткани рыбы, дает возможность косвенно судить о гистологической структуре ткани, о развитии денатурационных процессов и имеет важное практическое значение для оценки качества мороженой продукции, особенно пищевых рыбных фаршей. Определение ВУС сводится к определению в рыбе влаги связанной, удерживаемой гидрофильными веществами, главным образом белками. Гидратация белковых веществ обусловлена дипольным строением воды и наличием в молекулах белка активных функциональных групп (аминных, карбоксильных, гидроксильных), а также пептидных связей. Изменения, происходящие в белковой молекуле в результате автолиза, денатурации и т.д., вызывают нарушение связи влаги с белком. В результате потери белком способности удерживать воду последняя из формы связанной переходит в свободную. Это можно наблюдать в виде мышечных соков, вытекающих из рыбы после ее размораживания.
По рекомендации АтлантНИРО качество пищевых рыбных фаршей оценивают по следующей шкале:
хорошее – более 60%; удовлетворительное – 50-60%; неудовлетворительное – менее 50%.
ВУС определяют методом прессования или центрифугирования.
5.9.1. Определение ВУС методом прессования.
Метод основан на определении количества влаги, выделяющейся из продукта, при легком нажатии на него. Расчет можно вести как по определению площади пятна, образованного на бумажном фильтре выделившейся влагой (метод Грау и Гамма), так и по разности массы навески продукта до и после отделения влаги.
Проведение испытания:
Навеску фарша в количестве 0,3 г, взвешенную с точностью до 0,001 г на предварительно взвешенном кусочке полиэтилена, переносят на фильтровальную бумагу влажностью 8-9%, положенную на стеклянную или плексигласовую пластинку так, чтобы навеска была внизу под полиэтиленом. Сверху ее накрывают другой пластинкой и ставят груз массой 1 кг на 10 мин.
Затем фильтровальную бумагу с навеской освобождают и карандашом обводят контур фарша и контур образовавшегося влажного пятна. Полученный рисунок переносят на миллиметровую бумагу и измеряют площадь пятна в см2.
Содержание влаги связанной (Wсвя з) в % определяют по формуле:
где А – общее содержание влаги в навеске, мг (определяется путем умножения навески на общее содержание влаги в продукте; например, общее содержание влаги в продукте 68%, тогда А = 300*0,68 = 204 мг);
8,4 – коэффициент, найденный экспериментальным путем, показывает содержание влаги в 1 см2 влажного пятна, мг;
F – площадь влажного пятна, которую находят по разности между площадью пятна и площадью, образованной спрессованным мясом, см2;
m – навеска фарша, мг;
8,4* F – количество условно свободной влаги (определяется также по разности массы образца до и после прессования)
Вычисление проводят с точностью до 0,1 %.
Фильтровальная бумага влажностью 8-9% готовится следующим образом: беззольные фильтры в слабо связанных пачках помещают на три дня в эксикатор над насыщенным раствором хлористого калия. Вынув фильтры из эксикатора, их упаковывают в пергамент или полиэтиленовую пленку и хранят в прохладном месте.
5.9.2. Определение ВУС методом центрифугирования.
Проведение испытания:
Пробу в виде кусочка мяса массой 0,6-0,8 г, вырезанную из спинной части тела рыбы, или кусочек фарша в таком же количестве помещают в специальные центрифужные пробирки на сетчатые прокладки, взвешивают с точностью до 0,01 г, подвергают центрифугированию в течение 10 мин при скорости 1450 об/мин и снова взвешивают. Количество выделившегося мышечного сока (условно свободной влаги) выражают в миллиграммах и подставляют полученную величину в формулу для определения влаги связанной.
 2015-10-16
2015-10-16 1941
1941








