1. Определение свободного активного хлора (иодометрический метод)
При введении в воду хлор гидролизуется, образуя хлорноватистую и соляную кислоты.

 Cl2 + H2O
Cl2 + H2O  HOCl + HCl
HOCl + HCl
Образовавшаяся хлорноватистая кислота диссоциирует на ион гипохлорита OCl- и ион водорода Н+.
Хлор широко используется для обеззараживания сточных вод в оборотных системах водопотребления, а также перед сбросом их после очистки в канализацию или водоем. При сбросе СВ в водоем после полной биологической очистки содержание остаточного свободного активного хлора не должно превышать 2,5 мг/дм3.
Сущность метода. При подкислении анализируемой воды и прибавлении к ней иодида калия все перечисленные вещества выделяют йод:
Cl2 + 2J - = J2 + 2Cl -
НClО + 2J - + H+ = J2 + Cl - + H2O
ClO - + 2H + + 2J - = J2 + Cl - + H2O
NH2O + 2H+ + 2J - = J2 + NH4+ + Cl -
Выделившийся йод оттитровывают тиосульфатом натрия в присутствии крахмала. Содержание активного хлора выражают в мг/дм3 в пересчете на хлор. В отношении хлорноватистой кислоты, гипохлорит-ионов, монохлорамина такое выражение результатов анализа условно, т.к. один моль этих веществ выделяет два атома йода и, следовательно, соответствует 2 молям, активного хлора, т.е. результаты оказывается завышенными.
Реактивы
Тиосульфат натрия, 0,01 н. раствор;
Йодид калия, уксусная кислота, 30%-ный раствор;
Крахмал, 0,5%-ный раствор.
Ход определения. В коническую колбу, снабженную притертой стеклянной пробкой, наливают 50... 100 мл анализируемой воды, вносят 0,5 г йодида калия и добавляют 10 мл уксусной кислоты. Через 5 мин оттитровывают выделившийся йод 0,01 н. раствором тиосульфата натрия (при содержании активного хлора выше 1 мг/дм3) или 0,005 н. раствором тиосульфата натрия (при содержании активного хлора от 0,1 до 1 мг/дм3). В конце титрования прибавляют 1-2 мл раствора крахмала.
Содержание активного хлора (X) в мг/дм3 рассчитывают по формуле 1:
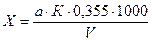
, (1)
где а - объем раствора тиосульфата натрия, израсходованного на титрование, см3;
К - поправочный коэффициент для приведения концентрации раствора тиосульфата натрия к точно 0,01 н.;
V - объем анализируемой воды, см3;
0,355 - количество хлора, эквивалентное 1 мл 0,01 н. раствора тиосульфата натрия, мг.
«Свободный активный хлор» и «связанный активный хлор»
Вещества, объединенные понятия «активный хлор» - это сильные окислители Cl2; HClO и ClO-, а «связанный хлор» это относительно слабые окислители NH2Cl; NHCl2 и NCl3, образующихся при хлорировании сточных вод, имеющих в своем составе аммонийные ионы, аммиак. Последующее поведение каждого из этих веществ при смешивании хлорированной сточной воды с другими сточными водами, при прохождении ее по трубам, значительно различается, поэтому иногда возникает необходимость дальнейших разделений.
В отношении «свободного активного хлора» обычно удовлетворяются определением суммарного содержания: Cl2 + HClO + ClO-, а для нахождения содержания каждого из хлораминов, надо провести определения следующим образом.
Сущность метода. В нейтральной среде (рН=6,9) свободный активный хлор (Cl2; HClO и ClO-) мгновенно реагируют с индикатором N, N/ - диэтил-n-фенилендиамином, образуя соединения красного цвета.
Монохлорамин и дихлорамин в этих условиях в реакцию с индикатором не вступают. Свободный активный хлор оттитровывают раствором соли Мора. Затем в раствор вносят очень малое количество иодида калия, каталитическое действие которого приводит к быстрому взаимодействию монохлорамина и индикатора с образованием того же красного цвета, которое оттитровывают раствором соли Мора. Затем вводят иодид калия в избытке, при этом в реакцию вступает дихлорамин, который определяют тем же титрованием. Если в сточной воде содержится трихлорид азота NCl3, то он будет частично определен как дихлорамин NHCl2.
Первое определение надо проводить очень быстро при рН 6,9 (или чуть выше), чтобы в реакцию не вступил монохлорамин NH2Cl. Для того, чтобы он прореагировал полностью требуется 2 мин; если раствор имеет повышенную температуру – 1 мин.
Реактивы
N,N-диэтил-n-фенилендиамин, сернокислая соль. Растворяют 0,15 г сернокислой соли диэтил-n-фенилендиамина в дистиллированной воде, не содержащей хлора, в которую предварительно вносят 2 см3 10% (по объему) раствора серной кислоты и 2,5 см3 0,8%-ного раствора ЭДТА. Раствор разбавляют до 100 см3 и хранят в склянке из железного стекла;
Фосфатный буферный раствор, рН=6,9. В дистиллированной воде растворяют 48,4 г Na2HPO4.2H2O и 30 г KH2PO4, прибавляют 100 см3 0,8% раствора ЭДТА и разбавляют до 1 дм3;
Стандартный раствор соли Мора Fe(NH4)2(SO4)2.6H2O, 1 см3 которого соответствует 0,1 мг хлора. В дистиллированную воду предварительно вводят 1 см3 25%-ного (по объему) серной кислоты, затем в ней растворяют 1,106 г соли Мора и разбавляют до 1 дм3;
Иодид калия. Для приготовления 0,5% раствора растворяют 0,5 г KI в 100 см3 дистиллированной воды. Для приготовления 10%-ного раствора растворяют 10 г KI в 100 см3 дистиллированной воды.
Ход определения.
1. Определение свободного активного хлора. В колбу для титрования, снабженную притертой пробкой, наливают сначала 5 см3 фосфатного буферного раствора (рН=6,9) и 5 см3 раствора сернокислой соли диэтил-n-фенилендиамина, перемешивают, вводят 100 см3 анализируемой пробы и сразу же титруют раствором соли Мора до полного обесцвечивания.
2. Определение монохлорамина. К раствору после определения свободного активного хлора приливают 1 см30,5%-ного раствора иодида калия, перемешивают и титруют раствором соли Мора до полного обесцвечивания.
3. Определение дихлорамина. После определения монохлорамина прибавляют 10 см3 10%-ного раствора иодида калия, перемешивают, дают постоять 2 мин и титруют раствором соли Мора до обесцвечивания.
Предполагается, что общая концентрация активного хлора не превышает 4 мг/дм3. В противном случае берут меньший объем пробы, а дистиллированную воду для разбавления вводят до введения в подготовительную смесь анализируемой пробы.
Содержание каждого вида активного хлора (Cl2; NH2Cl; NHCl2) (Х) в мг/дм3 вычисляют по формуле 2:
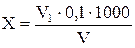 , (2)
, (2)
где V1 – объем раствора соли Мора, израсходованного в первом, втором или третьем титровании, см3;
V – объем пробы, взятой для анализа, см3;
0,1 – количество активного хлора, отвечающие 1 см3раствора соли Мора, мг.
2. Определение хлороемкости
Обработка сточных вод хлором или раствором хлорной извести – один из самых распространенных в относительно дешевых способов обеззараживания и очистки сточных вод от загрязнения органическими веществами. Но так как обычно СВ содержат реагирующие с хлором вещества и вещества, взаимодействующие с ним очень медленно или неполно, и органические вещества, совсем не окисляющиеся хлором, определение окисляемости сточной воды не дает достаточных данных для выводов о том, как вода будет хлорироваться. Поэтому, прежде чем решать вопрос об очистке СВ хлорированием, ее специально исследуют. При этом необходимо определить, с какой скоростью проходят реакции между содержащимися в воде веществами и хлором (реакции окисления и замещения хлором), доходят ли они до конца, какой требуется избыток добавляемого хлора для того, чтобы реакция пошла в желаемой степени в заданный промежуток времени. На эти вопросы можно получить ответы, определив хлороемкость сточной воды так называемым диаграммным методом.
Хлором обрабатывают как фильтрованную или отстоянную воду, так и вместе с содержащимися в ней взвесями.
Ход определения. Отбирают ряд одинаковых по объему порций анализируемой сточной воды и помещают их в сосуды с притертыми пробками, в которых их обрабатывают различными количествами хлорной воды (или раствора хлорной извести), первую порцию – наименьшим количеством, вторую – в 2 - 3 раза большим и т.д. Рекомендуется проводить две серии таких опытов, изменяя продолжительность обработки. Первую серию проб СВ обрабатывают различными количествами хлора очень непродолжительное время, например, 5 мин. Результаты этих опытов показывают присутствие в СВ веществ, быстро реагирующих с хлором. Вторую серию проб обрабатывают столько времени, сколько будет проводиться процесс хлорирования, в предполагаемых очистных сооружениях (обычно 1-2 ч). По истечении намеченного времени определяют в каждом растворе количество непрореагировавшего хлора (йодометрическим методом) и строят диаграмму, нанося на оси абсцисс количество введенного в каждый раствор хлора по порядку, начиная с самого малого, а на оси ординат – соответствующее количество оставшегося хлора, и соединяют полученные точки кривой (рис.1).
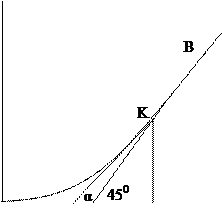 | |||
 | |||
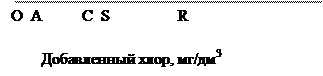 |
Рис. 1. Кривая определения хлороемкости
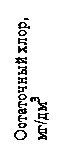  | |||
|
Рис. 2. Кривая йодометрического титрования активного хлора
Начальный участок ОА кривой совпадает с осью абсцисс: количество остаточного хлора равно 0. Длина этого участка показывает содержание в воде веществ, быстроокисляющихся хлором (особенно при построении кривой для первой серии опытов). В тех случаях, когда исследуемая вода содержит аммиак, аммонийные соли или некоторые органические амины, начальный отрезок кривой может получиться другой формы (рис. 2). Хлор образует с этими соединениями различные хлорамины, которые так же выделяют йод из йодида калия, как и прибавленный хлор. Дальнейшее прибавление хлора приводит к разрушению хлораминов, поэтому кривая, достигнув некоторого максимума, снова снижается, подходя к нижней точке перегиба.
Таким образом, создается неправильное представление, что первые порции прибавляемого хлора вообще не поглощаются сточной водой, а последующие - вызывают поглощение как вновь прибавленного хлора, так и ранее бывшего в СВ. Получение кривых, аналогично рис.1 возможно только при определении свободного хлора без хлораминов.
Сточные воды хлорируют сильнее, чем питьевую воду, при этом продолжают хлорирование и после перехода за точку полного разрушения хлораминов, поэтому рассматривается только нормальная форма кривой хлороемкости, которая должна получиться при определении только свободного остаточного хлора. Отрезок АК кривой (рис.1) характеризует процесс окисления и хлорирования веществ, медленно реагирующих с хлором, которые за время опыта не успевают прореагировать и остаются в растворе вместе с остаточным хлором. Отрезок KB (прямолинейный) показывает отсутствие в растворе к концу опыта веществ, реагирующих с хлором. Характеристику исследуемой воды можно получить следующим образом:
1. Измеряют отрезок ОА, длина его (а) характеризует содержание быстрореагирующих с хлором веществ.
2. Прямолинейный отрезок KB кривой продолжают до пересечения с осью абсцисс в точке С и определяют угол наклона прямой СВ к оси абсцисс (угол α). Если бы образовавшаяся в СВ хлорноватистая кислота не разлагалась,
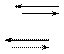 2 Cl2 + H2O 2HClO + 2 НCl
2 Cl2 + H2O 2HClO + 2 НCl
2 НCl 2HCl + O2
то количество хлора, прибавляемого после достижения точка К, была бы равна количеству остаточного хлора и прямая СВ была бы наклонена к. оси абсцесс под углом 45°. В действительности угол α- всегда меньше 450 и степень отклонения его от этого значения характеризует каталитическое разложение хлорноватистой кислоты.
3. Из точки К перехода кривой в прямую линию опускают на ось абсцисс перпендикуляр KR и проводят прямую KS, наклоненную к оси абсцисс под углом 45°. Длина отрезка OR=d показывает, сколько надо прибавить хлора, чтобы добиться полноты реакции его с присутствующими в воде окисляющими и хлорируемыми веществами за время проведения опыта.
4. Добавление хлора в количестве, соответствующем отрезку.OR, после опыта в растворе остается хлор в количестве, выражаемом отрезком KR. Так как KR = SR, то длина отрезка OS = ОR – SR = c показывает, сколько хлора расходуется на окисление, замещение хлором и на каталитическое разложение согласно приведенным выше уравнениям.
5. Отрезок ОС = В выражает количество хлора, израсходованного на окисление органических веществ и на хлорирование, т.е. действительную хлороемкостъ воды и поэтому с - h = CS = f показывает количество хлора, прореагировавшего с водой с образованием кислорода за время проведения опыта.
6. Если бы реакции между органическими веществами, содержащимися в сточной воде, и хлором проходили быстро и полностью, то после завершения этих реакций в растворе не содержалось бы свободного хлора и на диаграмме хлороемкости вместо кривой получилась бы ломаная линия ОСВ. Чем медленнее или менее полно проходят реакции в растворе, тем сильнее кривая ОАКВ. отклоняется от ломанной ОСВ и тем больше площадь АКС = Р. Последняя характеризует (условно) замедленность и не полноту происходящих реакции.
Реактивы: Хлорная вода (или насыщенный раствор хлорной извести). Насыщают дистиллированную воду хлором. Титр хлорной воды определяют каждый раз непосредственно перед определением хлороемкости, для этого к 10 мл хлорной воды добавляют 1 г сухого йодида калия и после подкисления титруют выделившийся йод 0,05 н раствором тиосульфата натрия, прибавляя 1 - 2 мл раствора крахмала в конце титрования. Раствор хлорной извести фильтруют и устанавливают его титр таким же способом.
Ход определения. В 10 конических колб вместимостью по 250 см3, снабженных притертыми пробками, наливают одинаковые объемы исследуемой воды. К взятым пробам прибавляют хлорную воду: в первый сосуд - 1 см3, во второй – 3 см3, дальше - 5, 8, 12, 15, 25, 40, 70 и 100 см3. Колбы закрывают притертыми пробками, ставят в темное место и выдерживают 5 мин при 16 – 200С (первая серия). Параллельно этим пробам ставят также другие пробы с теми же добавками хлорной воды, но дают постоять 1 или 2 часа (вторая серия).
По истечении намеченного времени в каждую колбу добавляют от 0,2 до 2 г (в зависимости от количества прибавляемой хлорной воды) сухого йодида калия, перемешивают до растворения, подкисляют 10 см3 уксусной кислоты и выделившийся йод оттитровывают 0,01 н раствором тиосульфата натрия. В конце титрования прибавляют 1 - 2 см3 раствора крахмала.
Содержание активного хлора (X) в мг/дм3 вычисляют по формуле 1:
Затем вычерчивают диаграмму (подобно показанной на рис.1), откладывая на оси абсцисс количество прибавленного хлора, а на оси ординат в том же масштабе - соответствующее им количество остаточного хлора. Полученные точки соединяют кривой. Для каждой серии опытов (с различными промежутками времени) строят отдельную диаграмму. Если перехода кривой линии в прямую на первой не получилось, то это указывает на недостаточное количества прибавленного хлора. Тогда опыты дополняют новыми с большими дозами хлорной воды.
Если, на первой диаграмме отсутствует участок ОА, это указывает на слишком большое количество хлора, введенного в первую порцию СВ. Тогда проводят еще несколько опытов с меньшими дозами хлора. Построив кривые, определяют по ним а, в, с, f, р и угол α.
Контрольные вопросы
1. С какой целью хлорируют сточную воду?
2. В каких случаях в сточной воде при хлорировании образуется хлорамины?
3. Как идет реакция гидролиза хлора в воде?
4. В чем сущность метода определения остаточного свободного хлора в сточной воде?
5. Как определяют свободный хлор в воде при наличии в ней хлораминов?
6. На какие ионы диссоциирует хлорноватистая кислота?
7. Для чего исследуют сточную воду на хлорируемость?
8. Зачем для определения хлорируемости сточных вод проводят две серии опытов?
9. В каких случаях кривая хлорируемости имеет вид как на рис.2?
10. Какой отрезок прямой на оси абсцисс указывает на расход хлора на окисление органических веществ и на хлорирование?
 2015-10-16
2015-10-16 8920
8920
