Знание содержания кислорода в воде имеет большое значение для оценки состояния водоема. Его снижение указывает на резкое изменение биологических процессов в водоемах, а также на их загрязнение биохимически интенсивно окисляющимися веществами. (В воде, используемой для хозяйственно-питьевых целей, его содержание в водном объекте должно быть не менее 4 мг/дм3 в любой период года). В сточных водах рыбообрабатывающих предприятий загрязнителями являются органические вещества, такие как белки, липиды, углеводы и продукты их гидролиза и окисления. Как правило, в этой воде растворенный кислород отсутствует. Растворенный кислород в сточной воде определяют при определении другого показателя – «биохимическое потребление кислорода» (БПК), когда по изменению содержания растворенного кислорода в сточной воде, специальным образом обогащенной кислородом, определяют его потребление бактериями в течение заданного времени. Таким временем обычно является 5-ти или 20-ти суточная экспозиция.
Под окисляемостью воды понимают количество кислорода искусственновведенного окислителя (например, KMnO4 или K2Cr2O7), идущее на окисление содержащихся в воде органических веществ. Различают перманганатную (KMnO4) и бихроматную (K2Cr2O7) окисляемость.
Кроме органических веществ могут окисляться некоторые неорганические восстановители, например, NO2, Fe2+, H2S и др. При значительном их содержании влияние на окисляемость воды учитывают при расчете. Представление о содержании в сточной воде легко окисляющихся органических веществ дает метод перманганатной окисляемости. Метод бихроматной окисляемости соответствует полному окислению органических веществ (легко и трудно окисляющихся), за исключением некоторых белковых соединений. Обычно перманганатная окисляемость составляет 40-50% от истинной окисляемости органических веществ, то есть полного окисления органического углерода до CO2.
Повышенная перманганатная окисляемость указывает на загрязнение воды. Окисляемость грунтовых вод составляет 2-4 мг/дм3O2, воды открытых водоемов – 5-6, в реках – до 6-8 мг/дм3O2. Вода считается пригодной для хозяйственных и питьевых целей, если перманганатная окисляемость ее не превышает 3 мг/дм3O2.
Метод перманганатного окисления для сточной воды не применяют из-за слабой окисляющей способности KMnO4. Обычно в ней определяют бихроматную окисляемость, и показатель имеет название «Химическое потребление кислорода» (ХПК). Значение величины ХПК указывает на количество кислорода (или окислителя в расчете на кислород) в мг/дм3 , потребное для полного окисления содержащихся в пробе органических веществ, при котором углерод, водород, сера, фосфор и др. элементы окисляются до CO2; H2O; P2O5; SO3 , а азот превращается в аммонийную соль. При этом кислород, входивший в состав окисляемых органических веществ, участвует в процессе окисления, а водород этих соединений отдает по три атома на каждый атом азота при образовании аммонийных солей.
1. Определение растворенного кислорода иодометрическим методом Винклера
Содержание растворенного кислорода определяют преимущественно в чистых водах и в сточных, прошедших через процесс химической или биохимической очистки перед спуском их в водоем. При смешении таких вод с водами водоемов содержание кислорода в последних не должно уменьшиться ниже минимально допустимой концентрации, которая составляет для водоемов, имеющих рыбохозяйственное значение, 6 мг/дм3. Содержание кислорода надо определять и в сточных водах, не подвергавшихся очистке, если незначительное содержание примесей допускает непосредственный их сброс в водоем. Растворенный кислород определяют для оценки коррозионных свойств сточных вод.
Содержание растворенного кислорода выражают в мг/дм3 и в процентах по отношению к равновесной концентрации кислорода при данной температуре. Равновесные концентрации кислорода в дистиллированной воде при нормальном давлении воздуха приведены в таблице1. Метод определения растворенного кислорода по Винклеру дает возможность определять кислород при содержании его не ниже 0,2-0,3 мг/дм3.
Существуют приборы (их называют «зондами»), с помощью которых растворенный кислород определяют автоматически. В этих приборах используют специальную мембрану, пропускающую кислород из анализируемой воды внутрь прибора, но не пропускающую жидкость. Полученные данные на приборе периодически сравнивают с арбитражным методом Винклера.
Сущность метода. В анализируемую пробу сточной воды вводят соль Mn(II) и едкую щелочь. Образуется осадок гидроксида марганца, который, окисляясь растворенным в воде кислородом, превращается в гидроксид марганца (III).
MnSO4 + 2 NaOH = Mn(OH)2 + Na2SO4
4 Mn(OH)2 + O2 + H2O = 4 Mn(OH)3
Гидроксид марганца (III) в свою очередь окисляет в кислой среде KI с образованием свободного иода в количестве, эквивалентном кислороду.
2 Mn(OH)3 + 3H2SO4 + 2 KI = 2 MnSO4 + K2SO4 + I2 + 6H2O
В избытке серной кислоты и иодида калия осадок растворяется. Выделившийся иод оттитровывают раствором тиосульфата натрия.
I2 + Na2S2O3 = 2 NaI + Na2S4O6
Для определения растворенного О2 применяют предварительно калиброванные склянки с хорошо пришлифованными пробками конической формы.
Калибрование проводят следующим образом: на технических весах взвешивают пустую склянку с точностью до 0,01 г, заполняют ее до верха дистиллированной водой, закрывают пробкой так, чтобы не осталось пузырьков воздуха, осушают горлышко бумагой или полотенцем и повторяют взвешивание. Вода и склянки до начала определения должны приобрести температуру комнаты (около 20°С).
Оборудование, реактивы, материалы
Кислородная склянка с притертой пробкой на 240 см3, предварительно прокалиброванная;
Пипетки на 1 см3, 2 см3;
Конические колбы на 250-500 см3;
Бюретка для титрования;
Мерные колбы на 50; 100; 250 см3;
Сульфат или хлорид марганца (II) раствор.
Растворяют 200 г MnSO4. 2H2O (или 240 г MnSO4. 4H2O или 182 г MnSO4. H2O или 212,5г MnCl2.4H2O) в дистиллированной воде и доводят объем до 0,5 дм3. Фильтруют через бумажный фильтр. Разбавленный раствор в кислой среде при добавлении KI не должен выделять свободного иода;
Щелочной раствор KI. а) растворяют 75 г KI в 50 см3 дистиллированной воды. При подкислении разбавленный раствор не должен выделять иод. б) растворяют 250 г NaOH или 350 г KOH в 250 см3 дистиллированной воды (предварительно прокипяченный для удаления CO2). Оба раствора смешивают и доводят объем до 0,5 дм3;
Серная кислота пл. 1,84 г/см3, разбавленный раствор 1:1;
Сульфаминовая кислота или карбамид, 40% раствор;
Тиосульфат натрия Na2S4O3 .4H2O 0,01 н;
Крахмал, 1% раствор свежеприготовленный.
Ход определения. Пробу сточной воды отбирают в прокалиброванные кислородные склянки с притертой пробкой вместимостью 240 см3 и сразу закрывают пробкой, чтобы под пробкой не образовались пузырьки воздуха. Сразу после этого фиксируют кислород, для чего в склянки при помощи концевой пипетки на 2 см3, погружая ее до дна, вносят 2 см3раствора MnSO4 или MnCl2. Другой такой же пипеткой в верхнюю часть склянки вносят 2 см3 щелочного раствора KI. Склянку осторожно закрывают пробкой, при этом из склянки вытекает 4 см3 исследуемой воды, т.е. столько, сколько налили реактивов. На эту потерю при расчете вносят соответствующую поправку. Затем жидкость перемешивают перевертыванием. В таком состоянии пробу оставить до образования хлопьевидного, хорошо выпадающего осадка.
Перед титрованием (осадок должен хорошо осесть) приливают 4 см3 H2SO4 (1:1). Раствор H2SO4 вносят и 0,15 см3 40%-ного раствора сульфаминовой кислоты или карбамида вносят пипеткой в нижнюю часть склянки, при этом часть жидкости переливается через край. Закрывают склянку притертой пробкой по тем же правилам и перемешивают до растворения осадка Mn(OH)3.
После этого всю пробу переливают в коническую колбу вместимостью 250-500 см3 и быстро титруют 0,01 н раствором тиосульфата натрия при непрерывном помешивании до слабо-желтого цвета, после чего прибавляют 1-2 см3 раствора крахмала и продолжают титровать до исчезновения синей окраски.
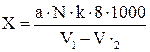 Расчет содержания растворенного кислорода в воде Х (мг/дм3) производится по формуле 1:
Расчет содержания растворенного кислорода в воде Х (мг/дм3) производится по формуле 1:
, (1)
где а - объем тиосульфата натрия, пошедшего на титрование, см3;
К - поправочный коэффициент для приведения концентрации раствора тиосульфата к точной нормальности;
N - нормальность Na2S2O3 для титрования;
V1 – объем пробы в склянке, см3 (240);
V2 - объем реактивов, добавленных до образования Mn(OH)2 4 см3;
1000 – пересчет на 1 дм3;
8 – эквивалентная масса кислорода, соответствующая 1 см3 1 н раствора Na2S2O3.
Для выражения концентрации кислорода не в мг/дм3, а в процентах по отношению к концентрации насыщенного кислородом раствора (y, %) пользуются данными формулы 2 и таблицы 1.
Y = 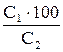 , (2)
, (2)
где С1 – найденная концентрация кислорода (Х), мг/дм3;
С2 – равновесная концентрация, взятая из таблицы 1 для температуры воды, измеренной при отборе пробы, с поправкой на атмосферное давление и на содержание в пробе растворенных солей.
Таблица 1 – Равновесные концентрации кислорода в дистиллированной воде
| Температура, °С | ||||||||||||||||
| Растворенный кислород (в мг/дм3 при изменении температуры на °С) | 14,65 | 14,25 | 13,86 | 13,49 | 13,13 | 12,79 | 12,46 | 12,14 | 11,84 | 11,55 | 11,27 | 11,00 | 10,75 | 10,50 | 10,26 | 10,03 |
продолжение таблицы 1
| Температура, °С | |||||||||||||||
| Растворенный кислород (в мг/дм3 при изменении температуры на °С) | 9,82 | 9,61 | 9,40 | 9,21 | 9,02 | 8,84 | 8,67 | 8,50 | 8,33 | 8,18 | 8,02 | 7,87 | 7,72 | 7,58 | 7,44 |
Поправка на атмосферное давление определяется по формуле [3]:
С/ = С P/760, (3)
где С/ - искомая равновесная концентрация при давлении Р, мг/дм3;
С – равновесная концентрация, найденная по таблице 1 для данной температуры воды (У), мг/дм3;
Р – атмосферное давление, мм. рт. ст.
Поправка на содержание солей в анализируемой пробе.
Из найденной по таблице 1 равновесной концентрации кислорода в дистиллированной воде вычитают на каждые 1000 мг/дм3 солей.
0,08405 мг/дм3 при температуре пробы 0°С;
0,06217 мг/дм3 при температуре пробы 10°С;
0,04777 при температуре пробы 20°С;
0,04085 при температуре пробы 30°С.
Определение биохимического потребления кислорода (БПК)
Биохимическим потреблением кислорода называется количество кислорода, необходимое для полного разложения в аэробных условиях присутствующих в сточной воде органических веществ путем биохимического окисления. БПК выражают в мгО2/дм3. Это определение не включает расход кислорода на нитрификацию.
Биохимическое окисление различных органических веществ происходит с разной скоростью. Кроме того, скорость окисления зависит от того, в какой степени присутствующая микрофлора в сточной воде адаптирована к находящимся в ней загрязнениям. Процесс биохимического окисления может быть относительно коротким (2-3 суток), но может достигать 15 и более суток. Поэтому определение БПК сточных вод надо проводить до конца, это так называемое БПК полное. Для сточных вод рыбообрабатывающих предприятий этот процесс может идти 20-22 суток. Чтобы подавить воздействие на СВ нитрифицирующих бактерий без отрицательного влияния на микроорганизмы, осуществляющие основной биохимический процесс окисления, вводят такие вещества, как этилентиокарбамид, аллилтиокарбамид, трихлорметилпиридин и др.
При анализе сточных вод, содержащих твердые взвешенные вещества, анализируют как профильтрованную пробу воды, так и всю воду вместе с осадком после тщательно перемешивания.
Следить за ходом процесса можно двумя способами: по тому как сокращается количество кислорода, введенного в склянку с пробой, и по тому, как уменьшается количество органических веществ. В соответствии с этим существуют и два метода определения БПК: «Метод разбавления» и «Метод определения по разности между результатами определения ХПК».
Метод разбавления
Сущность метода. Исследуемую сточную воду после двухчасового отстаивания разбавляют чистой водой, взятой в таком количестве, чтобы содержащегося в ней кислорода с избытком хватило для окисления всех органических веществ в сточной воде. Определив содержание растворенного кислорода в полученной смеси, ее оставляют в закрытых склянках на 2; 3; …n суток, определяя содержание кислорода по истечении каждого периода времени. Уменьшение количества кислорода в воде показывает, сколько его за это время израсходовано на окисление органических веществ. Это количество, отнесенное к 1 дм3 сточной воды, и является биохимическим потреблением кислорода сточной водой за данный период (БПК2; БПК3 …БПКn) то есть до БПКполное, когда поглощение кислорода прекратится. Если проба содержит нитриты, их разрушают введением сульфаминовой кислоты или оксида натрия. Заражать сточную воду следует адаптированной микрофлорой.
В общих сточных водах рыбообрабатывающих предприятий БПКполн. может достигать 2000 мг О2/дм3 и более.
Приборы и реактивы
Термостат, установленный на 20°С;
Кислородные склянки вместимостью 150-300 см3 с косо срезанным притертыми пробками, калиброванные с точностью до 0,1 см3. Проверку вместимости склянок определяют вычитанием массы пустой высушенной склянки с пробкой из массы склянки, наполненной при 20°С дистиллированной водой до притертой пробки и самой пробки;
Дистиллированную воду, используемую для приготовления разбавленной воды насыщают кислородом воздуха (т.е. аэрируют продолжительное время) и хранят в специально предназначенных для этих целей сосудов с пробками;
Фосфатный буферный раствор рН=7,2, раствор для приготовления разбавляющей воды. Растворяют 8,5 г KH2PO4; 21.75 г K2HPO4; 33,4 г Na2HPO4.7 H2O и 1,7 г NH4Cl в дистиллированной воде и доводят до 1 дм3;
Сульфат магния, раствор для приготовления разбавляющей воды. Растворяют 22,5 г MgSO4.7H2O чда в дистиллированной воде и доводят объем до 1 дм3;
Хлорид кальция, раствор для приготовления разбавляющей воды. Растворяют 27,5 г CaCl2 безводного чда в дистиллированной воде и доводят до 1 дм3;
Хлорид железа (III) раствор для приготовления разбавляющей воды. Растворяют 0,25 г FeCl3.6H2O чда в дистиллированной воде и доводят до 1 дм3;
Разбавляющая вода. К 1 дм3 дистиллированной воды, насыщенной при 20°С кислородом воздуха, прибавляют 1 см3 фосфатного буферного раствора, 1 см3 раствора сульфата магния, 1 см3 раствора хлорида кальция, 1 см3 раствора хлорида железа (III) и 1 см3 0,05%-ного раствора этилентиокарбамида. Непосредственно перед применением разбавляющей воды в нее вносят культуру микроорганизмов, адаптированную к составу анализируемой воды.
Этилентиокарбамид, 0,05 раствор (500 мг/дм3). Он может быть заменен аллилтиокарбамидом;
Остальные реактивы см. раздел 1.
Подготовка микрофлоры для заражения
Берут производственную сточную воду, разбавляют водопроводной водой до концентрации кислорода 100-150 мг/дм3 (по ХПК) и оставляют стоять при комнатной температуре 3-4 суток. За это время происходит спонтанное заражение отстоянной жидкости микроорганизмами. Жидкость отфильтровывают на бумажном фильтре от инфузорий, коловраток и других организмов, питающихся бактериями, а затем на мембранном фильтре № 3. На 10 дм3 разбавляющей воды достаточно 15-20 см3 фильтрата. Чтобы исключить поступление в разбавленную воду органических веществ, образовавшуюся пленку активного ила промывают несколько раз 0,5% раствором NaCl (физиологическим раствором). Фильтр с пленкой переносят в стакан с небольшим количеством разбавляющей воды образовавшегося бактериальную взвесь заливают в бутыль с приготовленной разбавляющей водой.
- Предварительная обработка. Перед проведением анализа сточные воды нейтрализуют, дехлорируют. Если анализу подвергается сточная вода вместе с взвешенными в ней твердыми частицами, то ее надо предварительно гомогенизировать. Если сточная вода содержит нитриты, то перед определением БПК их надо разрушить, добавляя сульфаминовую кислоту или оксид натрия (см. определение ХПК).
- Предварительное разбавление сточной воды. Степень разбавления сточной воды можно ориентировочно рассчитать по результату определения ХПК следующим образом.
Условно принимают, что для вод рыбообрабатывающих предприятий БПКполн =70% ХПК. Поскольку в воде после инкубации при правильно взятом разбавлении должно оставаться около 3-4 мг/дм3 кислорода, рассчитанную величину БПК делят на 4 или 5. Полученный результат показывает, во сколько раз надо разбавить анализируемую воду.
Пример: ХПК=2000 мг/ дм3, тогда БПКполн составит 1400 мг/ дм3. Эту цифру делим на 4. Следовательно, СВ нужно развести в 1400:4 = 350 раз.
Ход определения. Разбавление сточной воды проводят следующим путем. Берут мерную колбу на 100-500 см3 наливают с помощью сифона (чтобы в колбу не попадали пузырьки воздуха) разбавляющую воду до половины колбы, прибавляют точно отмеренное пипеткой объем исследуемой воды (в зависимости от рассчитанной кратности разбавления) и доливают до метки разбавляющей водой. Колбу закрывают пробкой и перемешивают несколько раз. При разбавлении необходимо следить за тем, чтобы разбавляющая вода и полученная в результате разбавления смесь имели температуру 18-20°С и рН не более 8,3 и не менее 7.
Разбавленную описанным выше способом СВ разливают с помощью сифона для последующей инкубации в 2 калиброванные склянки емкостью 150-300 см3, наполняя их доверху, и закрывают косо срезанными притертыми пробками так, чтобы не оставалось пузырьков воздуха. После этого склянки ставят в термостат при +20°С. Одновременно наполняют разбавляющей водой такие же калиброванные склянки (2 шт.). Каждой пробе исследуемой жидкости должна соответствовать одна проба с разбавляющей водой.
В одной из двух склянок с испытуемой водой и в одной из двух склянок с разбавляющей водой сразу же после постановки опыта определяют растворенный кислород. Остальные склянки помещают в термостат и держат в нем определенное время.
Через 2, 5, 10, 15, 20-25 (у нас через 14) суток от начала инкубации вынимают из термостата по одной склянке с испытываемой водой и по одной склянке с разбавляющей водой и определяют в них растворенный кислород.
БПКСВ (в мг О2/дм3) вычисляют по формуле 4:
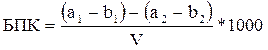 |
, (4)
где а1 – концентрация О2 в подготовленной для определения пробе в начале инкубации (в нулевой день), мг/ дм3;
а2 – концентрация О2 в разбавляющей воде в начале инкубации, мг/л;
b1 – концентрация O2 в пробе в конце инкубации, мг/ дм3;
b2 – концентрация О2 в разбавляющей воде в конце инкубации, мг/ дм3;
V – объем СВ, содержащихся в 1 дм3 пробы после всех разбавлений.
Этот показатель можно также определить по формуле 5:
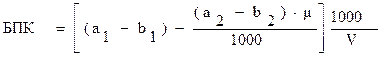 |
, (5)
где 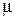 – количество разбавляющей воды, содержащейся в 1000 см3разбавленной пробы, см3;
– количество разбавляющей воды, содержащейся в 1000 см3разбавленной пробы, см3;
V – количество сточных вод, содержащихся 1000 см3разбавленной пробы, см3;
Определение химического потребления кислорода (ХПК)
Теоретическим значением ХПК называют количество кислорода (или окислителя в расчете на кислород) в мг/дм3, необходимое для полного окисления содержащихся в пробе органических веществ, при котором углерод, водород, сера, фосфор и др. элементы (кроме азота), если они присутствуют в органическом веществе, окисляются до CO2, H2O, P2O5, SO3, а азот превращается в аммонийную соль. При этом кислород, входящий в состав окисляемых органических веществ, участвует в процессе окисления, а водород этих соединений отдает по 3 атома на каждый атом азота при образовании аммонийных солей.
Если окисление органических веществ прошло не полностью, то результат будет заниженным, при этом вместе с органическими веществами окисляются и неорганические восстановители, если они были в пробе сточной воды.
Содержание неорганических восстановителей в пробе определяют тогда отдельно специальными методами, и полученные результаты вычитают из найденного значения ХПК.
ХПК - величина переменная, зависящая от вида, концентрации, температуры окислителя, длительности контакта с ним. Результаты близкие к теоретическому потреблению кислорода на окисление отдельных органических соединений дает применение в качестве окислителя двухромовокислого калия (K2Cr2O7). В условиях определения полному окислению подвергаются хлориды. Поэтому содержание хлоридов определяют в отдельной пробе (см. «Хлориды») и принимают во внимание при расчетах ХПК: на 1 мг хлорид-ионов расходуется 0,23 мг кислорода. Хлориды устраняют маскированием их сульфатом ртути в количестве 22,2 мг HgSO4 на 1 мг С1Ї.
Образующийся очень мало диссоциированный хлорид ртути (II) достаточно устойчив даже в присутствии большей концентрации серной кислоты и бихромата.
Анализировать можно предварительно профильтрованную или всю пробу с осадком в зависимости от поставленной цели. Если ХПК определяют в пробе сточной воды, взятой после отстойника и подлежащей сбросу в канализацию или водоем, ее предварительно не фильтруют, если анализ пробы должен показать эффективность применяемого метода очистки от органических веществ – предварительно фильтруют.
Сущность метода. Органические вещества окисляют бихроматом калия в 18 н. (разбавление 1:1) серной кислоте. Бихромат при этом восстанавливается согласно уравнению:
Cr2O72Ї + 14H + + 6ē = 2Cr 3+ + 7H2O
Окисление органических веществ ускоряется при введении в реакционную смесь катализатора - сульфата серебра,
Реактивы
Серная кислота пл. 1,84 г/см3 чда.;
Сульфат серебра твердый чда.;
N - фенилантраниловая кислота, 0,25 г кислоты растворяют в 12 см3 0,1 н раствора едкого натра и разбавляют водой до 250 см3;
Бихромат калия, 0,25 н стандартный раствор; 12,258 г бихромата калия предварительно высушенного в течение 2 ч при 105°С растворяют в дистиллированной воде и доводят объем этой водой до 1 дм3.
Соль Мора, приблизительно 0,25 н раствор. Растворяют 98 г соли Мора в дистиллированной воде, прибавляют 20 см3 концентрированной серной кислоты и доводят объем до 1 дм3.
Сульфат ртути (II) кристаллический чда.
Ход определения. Отбирают такой объем анализируемой пробы, чтобы на окисление расходовалось не более 20 см3 стандартного раствора бихромата калия и чтобы в ней содержалось не более 40 мг хлорид-ионов. (Если анализируют пробу с высоким содержанием хлорид-ионов, то соответственно увеличивают количество вводимого сульфата ртути (II) или пробу предварительно разбавляют дистиллированной водой). Пробу разбавляют до 50 см3 дистиллированной водой и переносят в круглодонную колбу вместимостью 300 см3. Прибавляют 1 г сульфата ртути (II) 5 см3 серной кислоты, перемешивают до растворения сульфата ртути, затем вливают 25 см3 стандартного раствора бихромата калия, очень осторожно, малыми порциями вливают 70 см3 серной кислоты, всыпают 0,4-0,5 г сульфата серебра, вводят в колбу несколько стеклянных бусин, закрывают пробкой, соединенной с обратным холодильником, и нагревают до слабого кипения, которое поддерживают 2 ч. Затем охлаждают, обмывают стенки холодильника 25 см3дистиллированной воды и переносят содержимое этой колбы в коническую колбу вместимостью 500 см3, обмывая стенки первой колбы несколько раз дистиллированной водой. Добавив дистиллированную воду до объема 350 см3, вводят 3-4 капли раствора ферроина (10-15 капель раствора N - фенилантраниловой кислоты) и оттитровывают избыток бихромата раствором соли Мора.
Проводят холостой опыт, для этого берут 50 см3 дистиллированной воды и проводят ее через все ступени анализа.
Химическое поглощение кислорода (ХПК), мг/дм3 сточной воды вычисляют по формуле 6:
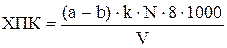 , (6)
, (6)
где a – объем раствора соли Мора, израсходованного на титрование в холостом опыте, см3;
b – объем того же раствора, израсходованного на титрование пробы, см3;
N – нормальность титрованного раствора соли Мора;
V – объем анализируемой сточной воды;
8 – эквивалент кислород;
k – поправочный коэффициент к нормальности титрованного раствора Мора.
Ускоренный метод определения ХПК
Этот метод предназначен для постоянных анализов, проводимых для контроля работы очистных сооружений или состояния воды в водоеме. Результаты определения, как правило, получаются несколько ниже, чем при анализе арбитражным методом. Главная особенность ускоренного метода – повышенная концентрация H2SO4. Нагревания извне не требуется, температура повышается за счет тепла, выделяющегося при смешении воды с концентрированной кислотой.
Ход определения. Если ХПК анализируемой воды находится в пределах 500 - 400 мг/дм3 кислорода, берут для анализа 1 см3 пробы, если ХПК – 50 - 500 мг/ дм3, отбирают 5 см3 пробы, если ХПК выше 4000 мг/ дм3 - пробу предварительно разбавляют, если же ниже 50 мг/ дм3: - этот метод применять нельзя,
В пробу вводят 2,5 см3 0,25 н раствора бихромата калия, затем 0,2 г сульфата ртути (11) и при перемешивании - концентрированную серную кислоту (7,5 см3 на 1 см3 пробы, 15 см3 - на 5 см3 пробы) и 0,25 г сульфата серебра. При этом температура раствора поднимается выше 100°С, Через 2 минуты охлаждают раствор до комнатной температуры, приливают 100 см3 дистиллированной воды, вводят 5 - 7 капель раствора N-фенилантраниловой кислоты и оттитровывают избыток бихромата титрованным раствором соли Мора. Проводят холостой опыт, для этого берут 1...5 см3 дистиллированной воды и проводят ее через все ступени анализа.
Расчет: ХПК, выраженное числом мг кислорода на 1 дм3 сточной воды, вычисляют по той же формуле, что и для арбитражного метода [ формула 6].
Контрольные вопросы
1. Для чего определяют в водоеме содержание растворенного кислорода?
2. Содержится ли в сточной воде рыбообрабатывающих предприятий растворенный кислород?
3. Какова минимально допустимая величина содержания кислорода в воде водоема, используемого в рыбохозяйственных, хозяйственно-питьевых целях?
4. Что подразумевается под понятием «окисляемость воды», и какие окислители применяют для ее определения?
5. Что такое показатель ХПК и его размерность?
6. В каких целях определяют растворенный кислород в сточной воде?
7. Как ведется определение показателя «растворенный кислород» в сточной воде?
8. Как проводится анализ сточной воды с целью определения в ней показателя ХПК, БПК?
9. Какова сущность метода определения растворенного кислорода в сточной воде по методу Винклера?
10. Что означает понятие БПКполн?
11. Как рассчитывается концентрация растворенного кислорода в воде в процентах?
12. Для чего при определении БПК используют разбавляющую воду?
13. За счет чего происходит окисление органических веществ в склянке со сточной водой, которую выдерживают в термостате при определении БПК?
14. Где, кроме лабораторных анализов по определению БПК, проходят аналогичные биохимические процессы?
15. В сточной воде рыбообрабатывающих предприятий, какая величина больше: БПКn или ХПК?
 2015-10-16
2015-10-16 9234
9234








