В мерные колбы емкостью 50 см3 последовательно прибавляют 0; 0,5; 1,0; 2,0; 4.0; 8,0; 10…40 см3 рабочего стандартного раствора Б и объем доводят бидистиллятом до 50 см3. Полученные растворы с концентрациями 0; 0,2; 0,4; 0,6; 0,8; 1,0…4.0 мг NН4+ в 1 дм3 обрабатывают описанным выше способом и строят график зависимости оптической плотности от содержания аммиака; вводят поправку на холостой опыт.
Содержание аммонийного азота в СВ мг/дм3 находят по формуле 3:
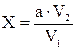 |
, (3)
где X - содержанке аммонийного азота, мг/ дм3;
a- найденная по калибровочной кривой концентрация NH4+, мг/ дм3;
V1 - объем пробы, взятой для анализа, см3;
V2 - объем окрашенной пробы, см3.
2. Хлориды
Хлориды – наиболее распространенная составная часть примесей сточной воды рыбообрабатывающих предприятий. Их в сточной воде может содержаться от естественного фона (300 мг/дм3) до 5000 мг/дм3 и более. Обычными способами очистки сточных вод они не устраняются, что ведет к постепенному засолению поверхностных вод. Из-за высокой солености сточные воды рыбообрабатывающих предприятий нельзя использовать для орошения полей.
Существует несколько методов определения хлоридов: аргентометрический метод без удаления и с удалением органических веществ прокаливанием при 600єС или с осаждением органических веществ коллоидным раствором гидрата окиси алюминия; меркурометрический метод. В данных методических указаниях будет рассмотрен только аргентометрический метод.
Применение этого метода с удалением органических веществ прокаливанием для данных СВ невозможно ввиду получения заниженных результатов (разложение хлористых солей с выделением Сl–), поэтому, если проба СВ мутная или окрашена, к ней добавляют коллоидный раствор гидрата окиси алюминия (из расчета на 100 см3 СВ добавляют 3 см3 коллоидного раствора), хорошо размешивают и через 2 мин фильтруют. Осадок промывают 10–15 см3 дистиллированной воды, которую присоединяют к фильтрату. После такой подготовки приступают к собственно определению.
Оборудование, реактивы, материалы
Электроплитка;
Термометр ртутный;
Колба коническая на 100 см3;
Мерная колба на 100 см3;
Пипетка на 1, 10 см3;
Воронка, фильтровальная бумага, поваренная соль, ч.д.а.;
Азотнокислое серебро (AgNO3) – 0,01 н раствор. Титр раствора проверяют с помощью раствора хлористого натрия, ч.д.а. Коэффициент пересчета, равный содержанию ионов Cl-, соответствующему 1 см3 AgNO3 определяют по формуле 4:
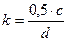 |
, (4)
где с - взятое количество 0,01 н. раствора NaCl, см3;
d - количество раствора AgNO3, пошедшего на титрование, см3;
0,5 - содержание ионов хлора в 1 см3 раствора NaС1.
Хромовокислый калий, 5%-ный раствор.
Коллоидный раствор гидрата окиси алюминия А1(ОН)3 – 125 г алюмо-калиевых квасцов KAl(SO4)2∙12H2O или сернокислого алюминия А12(SO4)3∙18H2O растворяют в 1 дм3 дистиллированной воды и нагревают до 60єС. К раствору добавляют 55 см3 концентрированного аммиака при постоянном размешивании. После охлаждения прозрачную жидкость декантируют.
Ход определения. Отмеряют 100 см3 сточной воды или меньшее количество. К пробе добавляют 1 см3 раствора хромовокислого калия, как индикатора (K2CrO4) и титруют раствором азотнокислого серебра (AgNO3 0,01 н раствор) до изменения цвета от желтовато-зеленого до апельсиново-желтого. Одновременно делают холостой опыт с дистиллированной водой. С целью облегчения наблюдения за изменением цвета индикатора оттитрованную пробу сравнивают с пробой, полученной при холостомм опыте с дистиллированной водой, поставленной рядом. Титрование производят в конической колбе, установленной на белом фоне.
Содержание хлоридов в анализируемой СВ (в мг/ дм3) определяют по формуле 5:
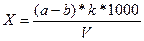 |
, (5)
где а – количество AgNO3, пошедшего на титрование пробы, см3;
b – количество AgNO3, пошедшего на титрование при холостом опыте, см3;
k – коэффициент пересчета, выражающий содержание ионов С1–, соответствующее 1 см3 раствора AgNO3, мг;
V – объем пробы, взятой для анализа, см3.
3. Щелочность
Щелочность чистой воды обуславливает, главным образом, содержание карбонатов, бикарбонатов и гидратов окисей. Щелочность промышленных сточных вод обуславливает характер перерабатываемого сырья, технологического процесса и другие факторы.
Определение щелочности необходимо производить непосредственно после отбора пробы.
Щелочностью называют содержание в воде веществ, вступающих в реакцию с сильными кислотами, т.е. с ионами водорода. К этим веществам относят: сильные основания, полностью диссоциирующие в разбавленных растворах с образованием гидроксид-ионов (едкий натр, едкое кали и т.д.), слабые основания (аммиак, пиридин и др.), анионы слабых кислот (НСО3–, H2PO4–, HSO3– и др.). Определение щелочности необходимо производить из фильтрата.
Различают щелочность по фенолфталеину, которую определяют в присутствии этого индикатора, или при рН 8, а также общую щелочность, которую определяют в присутствии метилоранжа, или при рН 4,0.
Щелочность по фенолфталеину представляет собой сумму всех соединений, реагирующих как щелочи в присутствии фенолфталеина, общая щелочность – сумму всех соединений, реагирующих как щелочи в присутствии метилоранжа (бикарбонаты, карбонаты, гидраты окисей, соли слабых кислот и сильных оснований).
Реактивы, материалы
Серная кислота, 0,02 н. раствор;
Индикатор фенолфталеин;
Индикатор метилоранж;
Колбы конические 100 см3;
Пипетки на 1 см3, 50см3.
Ход определения. Для определения щелочности по фенолфталеину отмеряют пипеткой 50-100 см3 исследуемой воды, добавляют 4 капли 1%-ного спиртового раствора фенолфталеина и титруют 0,02 н, раствором серной кислоты до обесцвечивания пробы.
Для определения общей щелочности в пробе, предварительно оттитрованной в присутствии фенолфталеина, добавляют 3 капли 0,1% раствора метилоранжа и титруют 0,02 н. раствором серной кислоты до первого ясно выраженного изменения цвета индикатора.
В загрязненных водах и стоках щелочность определяют потенциометрическим методом аналогичным образом. Титрование заканчивают при рН 8 или 4.
Щелочность по фенолфталеину (в мг СаСО3/дм3) определяют по формуле 6:
 |
, (6)
где а – количество серной кислоты, пошедшей на титрование пробы в присутствии фенолфталеина или при рН 8,0, см3;
V – объем титруемой пробы, см3;
N – нормальность серной кислоты;
50 – коэффициент пересчета, определяющий количестве СаСО3 (в мг/дм3), соответствующее 1 см3 1 н серной кислоты;
k - поправочный коэффициент к нормальности титрованного раствора серной кислоты.
Общую щелочность рассчитывают по этой формуле с той разницей, что " а " означает суммарное количество 0,02 н. серной кислоты, пошедшее на титрование пробы в присутствии фенолфталеина и метилоранжа, или до рН 4,0.
4. Фосфаты
В сточных водах фосфор содержится в виде органических и минеральных соединений в растворимом и нерастворимом состоянии. Как правило, определяют растворимые фосфаты. Присутствие этих соединений имеет большое значение при биологической очистке. В жидкой фазе он может быть в виде ортофосфорной кислоты и ее ионов и в виде разнообразных фосфорсодержащих органических соединений (нуклеиновые кислоты, нуклеопротеиды, фосфолипиды и др.), которые во время минерализации превращаются в ортофосфаты. Фосфаты можно определять методами титрования, колориметрическим и весовым.
Фотометрический метод определения растворенных ортофосфатов
Сущность метода. При взаимодействии ортофосфат-ионов с молибдатом в кислой среде образуется желтая гетерополикислота, которая под действием восстановителей превращается в интенсивно окрашенное синее соединение. Таким восстановителем является аскорбиновая кислота.
Оптическую плотность измеряют при 880 нм, если это невозможно, при наибольшей длине волны, которую допускает применяемый фотометр.
Все виды фосфора надо определить по возможности непосредственно после отбора пробы. Сточные воды фильтруют через плотный бумажный фильтр и в фильтрате определяют содержание растворимых форм азота. Биохимические процессы в пробе можно приостановить прибавлением 2-4 см3 хлороформа на 1 дм3 пробы. Консервирование подкислением недопустимо.
Реактивы
Серная кислота Н2SO4 5 н раствор;
Марганцевокислый калий КМnО4, 0,4 н раствор;
Сульфит натрия Na2SO3∙7H2O, 10%-ный раствор;
Молибдат аммония (NH4)6MO7O24∙4H2O, 3%-ный раствор;
Аскорбиновая кислота (хранят в склянке из полиэтилена), 0,25 н раствор (0,352 г аскорбиновой кислоты растворить в 100 см3 дистиллированной воды, применяют свежеприготовленный раствор).
Фосфат калия, однозамещенный, стандартный раствор, для построения калибровочного графика.
Основной раствор: растворяют 0,7165 г КН2РО4 чда, высушенного в течение 2 ч при 105єС, в дистиллированной воде, прибавляют 2 см3 хлороформа и разбавляют дистиллированной водой до 1 дм3. В 1 см3 этого раствора содержится 0,50 мг РО43–.
Рабочий раствор I: разбавляют 10 см3 основного раствора до 1 дм3 дистиллированной водой. В 1 см3 этого раствора содержится 0,005 мг РО43–. Применяют всегда свежеприготовленный раствор.
Рабочий раствор II. Разбавляют 50 см3 рабочего раствора I до 250 см3 дистиллированной водой. В 1 см3 содержится 0,001 см3 РО43–.
Ход определения. Отбирают 50 см3 профильтрованной в день отбора пробы сточной воды. Если фосфора много, отбирают меньшую порцию воды и разбавляют до 50 см3. К пробе приливают 6,5 см3 H2SО4, 5 см3 КМnО4 и кипятят 10 минут. Затем прибавляют 1 см3 10%-ного раствора сульфита натрия для восстановления избытка КМпО4. Когда раствор обесцветится, его кипятят для удаления сернистого ангидрида (объем при этом уменьшается). Охлаждают, переносят в мерную колбу на 50 см3, доводят дистиллированной водой до метки, перемешивают, прибавляют 2,5 см3 раствора молибдата аммония и 1 см3 аскорбиновой кислоты. Раствор перемешивают, вынимают из колбы пробку и помещают в кипящую водяную баню на 15 мин. После охлаждения окрашенный раствор переносят в кювету ФЭК (ширина кюветы 5 см) и измеряют оптическую плотность при длине волны максимально возможной для данного прибора (вплоть до 610 нм) по отношению к раствору, полученному в холостом опыте, в котором 50 см3 дистиллированной воды обрабатывают так же, как анализируемую пробу. Содержание фосфат-ионов РО43– находят по калибровочной кривой, для построения которой готовят стандартные растворы, содержащие от 0,001 до 0,05 мг фосфора, приливают в каждый раствор по 6,5 см3 серной кислоты и разбавляют до 50 см3. Затем обрабатывают эти растворы молибдатом аммония и аскорбиновой кислотой, как анализируемую пробу, и измеряют оптическую плотность.
Содержание РО43– (в мг/ дм3) вычисляют по формуле 7:
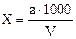
, (7)
где a – концентрация РО43–, найденная по калибровочной кривой, мг;
V – объем исследуемой воды, взятой для определения, см3.
5. Фенолы
В сточные воды рыбоперерабатывающих предприятий фенолы попадают в стоки из коптильных цехов при мойке коптильных печей, клетей, дымоводов. Перед сбросом сточных вод от санитарной обработки коптильных цехов в общие стоки предприятия из них предварительно удаляют легко оседающие смолистые вещества путем отстаивания. Фенолы обнаруживаются в сточной воде по характерному запаху уже при концентрации 0,01 мг/ дм3.
Под определением содержания фенола понимают определение всех гидропроизводных бензола, которые дают такую же реакцию в условиях определения.
Определение проводят не позднее чем через 4 ч после отбора пробы. Если это невозможно, пробу консервируют ортофосфорной кислотой до рН 4 (индикатор метилоранж). Если в пробе присутствует сероводород или SО2, ее насыщают воздухом или взбалтывают. Затем к пробе на каждый дм3 сточной воды добавляют 1 г CuSO4.5H2O. Для определения фенола в сточной воде до 1 мг/дм3 применяют колориметрический метод с 4-аминоантипирином. Консервирование пробы и последующая дистилляция устраняют действие всех примесей, являющихся помехой для определения.
Сущность метода. Метод основан на образовании окрашенных соединений фенола, его производных и гомологов с 4-аминоантипирином в присутствии гексацианоферрата (III) или персульфата аммония при рН 10,6±0,2.
Реакция фенола с 4-аминоантипирином протекает по схеме:
|
|
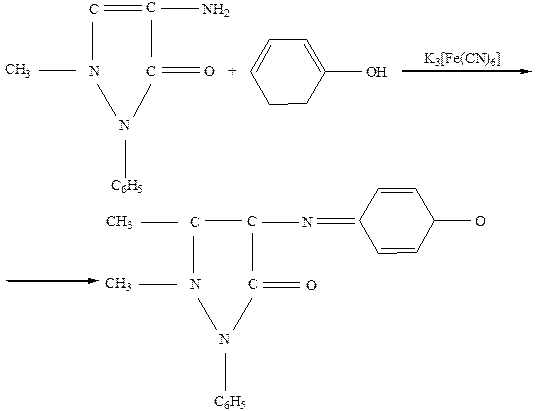
Реактивы
Буферный раствор с рН 10. Растворяют 12,5 г хлорида аммония в 100 см3 25 % раствора гидрата окиси аммония;
Cульфат меди, 10% раствор;
Фосфорную концентрированную кислоту (85%-ную) разбавляют в соотношении 1:9;
Гексацианоферрат калия (III), 8% раствор. Растворяют 8 г K3[Fe(CN)6], чда в дистиллированной воде и разбавляют до 100 см3. Раствор пригоден только одну неделю;
4-аминоантипирин, 2% водный раствор;
Хлороформ, чда;
Стандартный раствор фенола.
Стандартный раствор фенола. Основной раствор. В дистиллированной воде (свежепрокипяченной) растворяют 1,0 г фенола чда и разбавляют такой же водой до 1 дм3.
Рабочий раствор I. Разбавляют 10 см3 основного стандартного раствора до 1 дм3 дистиллированной водой. В 1 см3 полученного раствора содержится 10 мкг фенола. Раствор готовят в день выполнения анализа.
Рабочий раствор II. Разбавляют 50 см3 рабочего стандартного раствора I до 500 см3 дистиллированной водой. 1 см3 полученного раствора содержит 1 мкг фенола. Этот раствор надо приготовить не раньше, чем за два часа до начала анализа.
Калибровочную кривую строят таким образом, чтобы наименьшая определяемая концентрация фенола составляла 0,1 мг/дм3, максимальная - 3 мг/дм3. Она представляет собой прямую линию.
Калибровочный график. Для определения малых концентраций в мерные колбы вместимостью 500 см3 наливают 05; 1,0; 5; 10; 20; …50 см3 рабочего раствора II, что означает содержание 05; 1,0; 5; 10; 20; …510 мкг фенола. Содержимое колб доводят до метки дистиллированной водой, перемешивают и дальше продолжают как при анализе пробы, перенося их в стакан вместимостью 1 дм3, прибавляя раствор хлорида аммония и т.д. По результатам измерения оптической плотности строят график в координатах: по оси абсцисс откладывают содержание фенолов, мкг; по оси ординат – оптическую плотность, Д.
Для определения больших концентраций в стаканы вместимостью 200 см3помещают 10; 20; …50 см3 стандартного рабочего раствора фенола I, что соответствует содержанию 0,1; 0,2; …0,5 мг фенола, разбавляют каждый раствор дистиллированной водой до 100 см3 и продолжают дальше, как при анализе пробы. Строят график: по оси абсцисс – содержание фенола, мг, по оси ординат – оптическую плотность.
Ход определения. Пробу сточной воды объемом 100-250 см3 (в зависимости от содержания фенола) помещают в колбу отгонного аппарата, доводят при необходимости объем до 250 см3 дистиллированной водой, прибавляют 5 см3 раствора фосфорной кислоты (1:9), 2,5 см3 раствора сульфата меди и отгоняют 225 см3. К остатку в перегонной колбе добавляют 25 см3 дистиллированной воды и отгоняют еще 25 см3.
Далее 100 см3 дистиллята (или весь дистиллят, если в нем содержание фенола не превышает 50 мкг) разбавляют до 250 см3 и переносят в стакан вместимостью 500 см3. В другой стакан наливают аликвотное количество дистиллированной воды для холостого опыта. В оба стакана приливают по 2,5 см3 буферного раствора. Смесь переносят в делительную воронку емкостью 0,5 дм3; прибавляют 1,5 см3 раствора 4-аминоантипирина, перемешивают, добавляют 1,5 см3 раствора гексацианоферрата (III) калия, перемешивают и оставляют на 3 мин, после чего сразу экстрагируют 15-25 см3 хлороформа. Взбалтывают 10 раз, дают хлороформу отстояться, потом снова взбалтывают столько же раз и дают хлороформу собраться внизу воронки.
Хлороформный экстракт фильтруют через бумажный фильтр, поместив, в него 5 г обезвоженного сульфата натрия и доводят хлороформом фильтрат до определенного объема. Измеряют оптическую плотность в кювете с толщиной слоя 5 см по отношению к раствору холостого опыта при длине волны 460 нм. Содержание фенола находят по калибровочному графику.
Содержание летучих с паром фенолов в расчете на простой фенол C6H5OH (Х) в мг/дм3 находят по формуле 8:
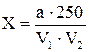 , (8)
, (8)
где а - содержание фенола, найденное по калибровочному графику, мкг;
V1 - объем пробы, взятой для анализа, см3;
V2 - объем аликвотной порции дистиллята, взятой для экстракции, см3;
250 - объем дистиллята, см3.
6. Эфирорастворимые вещества
Растительные и животные жиры и масла (а также соли высокомолекулярных жирных кислот – мыла) встречаются в сточных водах пищевой промышленности. Сточные воды рыбообрабатывающих предприятий содержат рыбные жиры и растительное масло в свободном, а чаще в эмульгированном состоянии. Их содержание в сточной воде рыбообрабатывающих предприятий может составлять от следов до 30 г/ дм3 и более.
Сущность метода. Многократной экстракцией петролейным эфиром извлекают из сточной воды все растворимые в этом экстракте вещества: растительные и животные жиры и масла. Если экстракцию проводят при рН>2, то соли жирных кислот (мыла) остаются в водном растворе. Из экстракта удаляют растворитель выпариванием и, взвешивая остаток, находят суммарное содержание всех жиров.
Приборы, реактивы, материалы
Сушильный шкаф;
Аналитические весы;
рН-метр;
Водяная баня;
Делительная воронка;
Цилиндр на 100 см3;
Пипетка на 1,10 см3;
Колба мерная на 50, 100 см3;
Бюкса;
Петролейный эфир;
Сернокислый натрий, безводный;
Хлористый натрий, кристаллический;
Ортофосфорная кислота, 10% раствор.
Ход определения. Сточная вода должна иметь рН>2<5, что достигается использованием разбавленной фосфорной кислоты.
Перед экстракцией в пробу сточной воды вводят 2-3 г NaCl. Если разделение слоев после экстракции проходит плохо, количество прибавляемого NaCl увеличивают.
Пробу сточной воды 100-200 см3 (в зависимости от предполагаемого содержания жиров) вносят в делительную воронку подходящей вместимости, прибавляют ортофосфорную кислоту (или серную, разбавленную 1:3 до рН<5, приливают 20 см3 петролейного эфира и сильно встряхивают несколько минут. Затем дают постоять до разделения слоев, переносят слой растворителя в колбу, снабженную притертой пробкой, а водный раствор вновь переносят в делительную воронку и обрабатывают второй порцией эфира 20 см3 и полученный экстракт присоединяют к первому. Такую операцию проводят несколько раз порциями по 20-25 см3, обмывая эфиром стенки всех применяемых стеклянных сосудов. Эфирную мисцеллу высушивают прокаленным сульфатом натрия, переносят в сухую мерную колбу вместимостью 50-100 см3 фильтруя, через бумажный фильтр, и доводят до метки петролейным эфиром.
Отобрав аликвотную порцию мисцеллы из мерной колбы, переносят ее во взвешенный предварительно бюкс и осторожно удаляют петролейный эфир нагреванием на водяной бане, а в конце при 105°С в сушильном шкафу, после охлаждения в эксикаторе бюкс еще раз взвешивают.
Содержание эфирорастворимых веществ (Х) в мг/дм3 определяют по формуле 9:
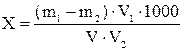 , (9)
, (9)
где m1 - масса бюкса с остатком после удаления петролейного эфира, мг;
m2 - масса пустого бюкса, г;
V - объем пробы сточной воды, взятой для анализа, см3;
V1 – вместимость мерной колбы с мисцеллой, см3;
V2 - объем пробы мисцеллы, взятой для выпаривания, см3.
7. Определение активной реакции (рН)
Водородный показатель выражают величиной рН, представляющей собой десятичный логарифм концентрации ионов водорода, взятый с обратным знаком; рН определяют в интервале от 1 до 14. В большинстве природных вод рН находится в пределах от 6,5 до 8,5 и зависит от соотношения концентраций свободного диоксида углерода и бикарбонат-иона. Данный показатель является индикатором загрязнения открытых водоемов при выпуске в них кислых или щелочных сточных вод.
Знать величину рН необходимо при определении карбонатов, двуокиси углерода, степени коррозионной активности воды, а также при контроле установок для умягчения воды, для контроля хода процессов нейтрализации, реагентной обработки, биологических процессов очистки и т.д.
Величина рН, равная 7, точно соответствует нейтральной среде, в кислой среде рН можно иметь значения от 0 до 7, а в щелочной – от 7 до 14. рН отражает только концентрацию водородных ионов в момент определения, в то время как щелочность и кислотность воды зависят также от буферного действия соединений, содержащихся в анализируемой пробе. В результате происходящих в воде химических и биохимических процессов и потерь углекислоты рН воды может быстро изменяться, и этот показатель следует определить сразу же после отбора пробы, желательно на месте отбора.
Для определения рН воды применяются специальные реактивы – индикаторы, а также приборы – рН-метры со стеклянными электродами. С помощью универсальной индикаторной бумаги можно определить рН с точностью до 0,2 – 0,3 единиц рН. Изменение рН цветных растворов и суспензий индикаторным способом невозможно.
Электрический (потенциометрический) метод определения рН воды отличается большой точностью (до 0,02) позволяет проводить исследование практически в любой воде независимо от ее окраски, мутности, солевого состава.
Метод основан на измерении разности потенциалов, возникающих на границе между внешней поверхностью стеклянной мембраны электрода и исследуемым раствором с одной стороны, и внутренней поверхностью мембраны и стандартного раствора – с другой. Внутренний стандартный раствор стеклянного электрода имеет постоянную концентрацию ионов водорода, поэтому потенциал на внутренней поверхности мембраны не меняется. Измеряемая разность потенциалов определяется потенциалом, возникающим на границе внешней поверхности электрода и исследуемого раствора. Изменение значения рН на единицу вызывает изменение потенциала электрода на 58,1 мВ при 20°С.
Стеклянные электроды этих приборов должны быть прокалиброваны с буферным раствором, имеющим определенные значения рН. Поскольку зависимость между потенциалом электрода и значением рН раствора, в который он погружен, линейна, то для калибрования достаточно двух буферных растворов, но для большей точности не менее трех растворов.
1. Буферный раствор, рН=4,00 при 20°С (4,01 при 25°С). Растворяют 10,211г высушенного при 110°С гидрофталата калия KHC8H4O4 чда в свежепрокипяченной и охлажденной воде и доводят объем до 1 дм3.
2. Буферный раствор рН=6,88 при 20°С (6,86 при 25°С). Растворяют 3,4 г безводного дигидрофосфата калия KH2PO4 и 3,55 г безводного гидрофосфата натрия Na2HPO4, предварительно высушенных при 110-130°С, в свежепрокипяченной и охлажденной дистиллированной воде и доводят объем при 20°С до 1 дм3.
3. Буферный раствор, рН=9,23 при 20°С (9,18 при 25°С). Растворяют 3,814 г тетрабората натрия Na2B4O7.10H2O чда, сохранявшегося продолжительное время над расплывающимися кристаллами бромида натрия, в свежепрокипяченной и охлажденной дистиллированной воде и доводят объем при 20°С до 1 дм3.
Перед каждым определением электроды промывают дистиллированной водой и высушивают между листами фильтровальной бумаги. Если анализируемая проба содержит жиры или масла, после выполнения определения электроды обтирают тонкой, мягкой тканью, смоченной эфиром или ПАВами, затем промывают дистиллированной водой.
При необходимости электрод регенерируют, погружая его на 2 ч в 2 % раствор соляной кислоты и тщательно промывают дистиллированной водой. Хранят стеклянный электрод в дистиллированной воде.
При сбросе сточных вод рыбообрабатывающих предприятий в канализацию или водоем рН воды допускается в интервале 6,5-8,5 единиц, поэтому при необходимости сточная вода нейтрализуется.
Оборудование, реактивы, материалы
рН-метр;
Эталонные растворы;
Химические стаканы на 100-200 см3;
Фильтровальная бумага.
Ход определения. Перед началом работы проверяют показание рН по дистиллированной воде, затем вынимают электродную систему из воды, подсушивают фильтровальной бумагой и определяют значение рН исследуемой сточной воды. Замеры делают трижды и вычисляют среднее значение.
Контрольные вопросы
1. В каком виде могут присутствовать азотистые вещества в сточной воде рыбообрабатывающих предприятий?
2. Что такое «мокрое сжигание» органических веществ и зачем оно проводится?
3. Как в сточной воде определяют аммоний азот объемным способом?
4. Какова сущность метода определения аммонийного азота с использованием реактива Несслера?
5. От каких технологических процессов в сточные воды попадают хлориды?
6. Каково примерное содержание хлоридов в пресной воде?
7. Можно ли сточные воды рыбообрабатывающих предприятий использовать для орошения сельскохозяйственных угодий и почему?
8. В чем состоит сущность метода определения хлоридов в сточной воде?
9. В каком виде могут содержаться фосфаты в сточной воде рыбообрабатывающих предприятий?
10. Как консервируют сточную воду, когда собираются определять в ней фосфаты и почему?
11. Как определяют фосфаты в сточной воде?
12. Каковы источники загрязнения сточной воды рыбообрабатывающих предприятий фенолами?
13. Как консервируют сточную воду, если в ней планируют определять фенолы?
14. Какова сущность метода определения фенолов в сточной воде?
15. Каков метод определения фенолов в сточной воде?
16. Какие вещества, содержащиеся в сточной воде рыбообрабатывающих предприятий, относятся к эфирорастворимым и от каких технологических операций они попадают в сточные воды?
17. Как проводится определение эфирорастворимых веществ в сточной воде?
18. Как сильно загрязнены сточные воды рыбообрабатывающих предприятий эфирорастворимыми веществами?
19. Какими способами можно очистить сточные воды от эфирорастворимыми веществ и каков эффект очистки по каждому из названных методов?
20. Что означает выражение «величина рН»?
21. Как определяют рН с использованием рН-метра?
22. Как хранят стеклянный электрод рН-метра в нерабочее время?
23. Как регенерирует стеклянный электрод при перерывах в работе?
24. На чем основан метод определения рН с использованием рН-метра?
25. При каких значениях содержания эфирорастворимых веществ сточная вода является слабо-, средне- и сильнозагрязненной?
26. В каком интервале укладываются значения рН, допустимые для сброса сточных вод в канализацию и водоем и чем это обусловлено?
27. С какой точностью можно определить значения рН при использовании индикаторной бумаги, рН-метра?
28. Что означает понятие «активная реакция» сточной воды (рН)?
29. Почему метод определения рН на рН-метре называется потенциометрическим?
 2015-10-16
2015-10-16 4194
4194








