Физико-химические и биологические свойства белков определяются их аминокислотным составом. Аминокислоты - это аминопроизводные класса карбоновых кислот. Аминокислоты входят не только в состав белков. Многие из них выполняют специальные функции. Поэтому в живых организмах различают аминокислоты протеиногенные (кодируются генетически) и непротеиногенные (не кодируются генетически). Протеиногенных аминокислот 20. 19 из них являются a-аминокислотами. Это означает, что аминогруппа у них присоединена к a-углеродному атому той карбоновой кислоты, производным которой они являются. Общая формула этих аминокислот выглядит следующим образом:
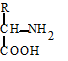 |
 |
Только одна аминокислота - пролин не соответствует этой общей формуле. Ее относят к иминокислотам.
a-углеродный атом аминокислот является ассимметричным (исключение составляет аминопроизводное уксусной килоты - глицин). Это означает, что у каждой аминокислоты имеются, как минимум, 2 оптически активных антипода. Природа выбрала для создания белков L-форму. Поэтому природные белки построены из L-a- аминокислот.
Во всех случаях, когда в молекуле органического соединения атом углерода связан с 4 разными атомами или функциональными группами, этот атом ассиметричен, поскольку он может существовать в двух изомерных формах, называемых энантиомерами или оптическими (стерео-) изомерами. Соединения с ассимметричными атомами "С" встречаются в виде двух форм (хиральных соединений) - левой и правой, в зависимости от направления вращения плоскости поляризации плоскополяризованного света. Все стандартные аминокислоты кроме одной (глицин) содержат в a-положении ассимметричный атом углерода, с которым связаны 4 замещающих группы. Поэтому они обладают оптической активностью, то есть способны вращать плоскость
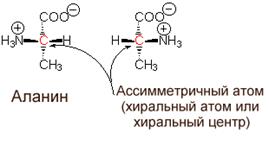
поляризации света в том или ином направлении.
Однако в основе системы обозначения стереоизомеров лежит не вращение плоскости поляризации света, а абсолютная конфигурация молекулы стереоизомера. Для выяснения конфигурации оптически активных аминокислот их сравнивают с глицериновым альдегидом - простейшим трехуглеродным углеводом, который содержит ассимметричный атом углерода. Стереоизомеры всех хиральных соединений, независимо от направления вращения плоскости поляризации плоскополяризованного света, соответствующие по конфигурации L-глицериновому альдегиду, обозначаются буквой L, а соответствующие D-глицериновому альдегиду - буквой D. Таким образом, буквы L и D относятся к абсолютной конфигурации 4 замещающих групп при хиральном атоме "С", а не к направлению вращения плоскости поляризации.
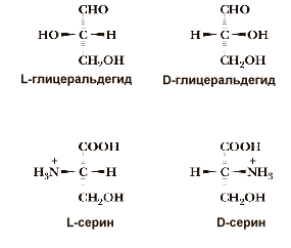
Классификация аминокислот проводится по строению их радикала. Существуют разные подходы к классификации. Большая часть аминокислот - это алифатические соединения. 2 аминокислоты являются представителями ароматического ряда и 2 - гетероциклического.
Аминокислоты можно разделить, по их свойствам, на основные, нейтральные и кислые. Они отличаются числом амино- и карбоксильных групп в молекуле. Нейтральные - содержат по одной амино- и одной карбоксильной группе (моноаминомонокарбоновые). Кислые имеют 2 карбоксильные и одну аминогруппу (моноаминодикарбоновые), основные -2 аминогруппы и одну карбоксильную (диаминомонокарбоновые).
1. Собственно алифатическими можно назвать 5 аминокислот. Глицин или гликокол (Гли),
 |
при работе с компьютером - (G), - a-аминоуксусная кислота. Является единственной оптически неактивной аминокислотой. Глицин используется не только для синтеза белков. Его атомы входят в состав нуклеотидов, гема, он входит в состав важного трипептида - глутатиона.
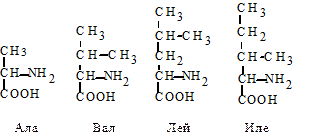
Аланин (Ала), при работе с компьютером - (А) - a-аминопропионовая кислота. Аланин нередко используется в организме для синтеза глюкозы.
По структуре все аминокислоты, за исключением глицина, можно рассматривать как производные аланина, у которого один или несколько атомов водорода в составе радикала замещены различными функциональными группами.
Валин (Вал), при работе с компьютером (V) - аминоизовалериановая кислота. Лейцин (Лей, L) - аминоизокапроновая кислота. Изолейцин (Иле, I) - a-амино-b-этил-b-метилпропионовая кислота. Эти три аминокислоты, обладая выраженными гидрофобными свойствами, играют важную роль в формировании пространственной структуры белковой молекулы.
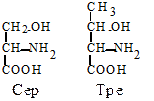 |
2. Гидроксиаминокислоты. Серин (Сер, S) - a-амино-b-гидроксипропионовая кислота и треонин (Тре, T) - a-амино-b-гидроксимасляная кислота играют важную роль в процессах ковалентной модификации структуры белков. Их гидроксильная группа легко взаимодействует с фосфорной кислотой, что бывает необходимым для изменения функциональной активности белков.
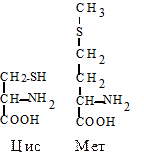 |
3. Серусодержащие аминокислоты. Цистеин (Цис, C) - a-амино- b-тиопропионовая кислота. Специальным свойством цистеина является способность к окислению (в присутствии кислорода) и взаимодействию с другой молекулой цистеина с образованием дисульфидной связи и нового соединения - цистина. Эта аминокислота благодаря активной -SH группе легко вступает в окислительно-восстановительные реакции, защищая клетку от действия окислителей, участвует в образовании дисульфидных мостиков, стабилизирующих структуру белков, входит в состав активного центра ферментов.
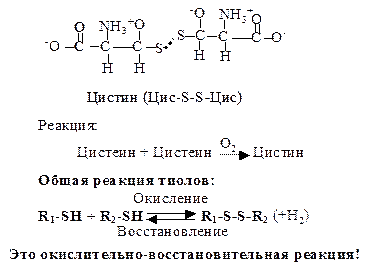
Метионин (Мет, M) - a-амино-b-тиометилмасляная кислота. Выполняет функцию донора подвижной метильной группы, необходимой для синтеза биологически активных соединений: холина, нуклеотидов и т.д. Это гидрофобная аминокислота.
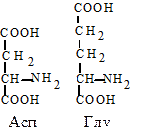 |
4. Дикарбоновые аминокислоты. Глутаминовая (Глу, E) - a-аминоглутаровая кислота и аспарагиновая кислота (Асп, D) - a-аминоянтарная кислота. Это наиболее распространенные аминокислоты белков животных организмов. Обладая дополнительной карбоксильной группой в радикале, эти аминокислоты способствуют ионному взаимодействию, придают заряд белковой молекуле. Эти аминокислоты могут образовывать амиды.
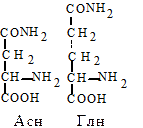 |
5. Амиды дикарбоновых аминокислот. Глутамин (Глн, Q) и аспарагин (Асн, N). Эти аминокислоты выполняют важную функцию в обезвреживании и транспорте аммиака в организме. Амидная связь в их составе частично имеет характер двойной. За счет этого амидная группа обладает частичным положительным зарядом и не будет диссоциировать.
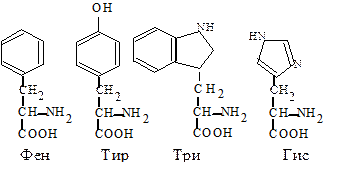 |
6. Циклические аминокислоты имеют в своем радикале ароматическое или гетероциклическое ядро. Фенилаланин (Фен, F) - a-амино-b-фенилпропионовая кислота. Тирозин (Тир, Y) - a-амино-b-параоксифе-нилпропионовая кислота. Эти 2 аминокислоты образуют взаимосвязанную пару, выполняющую важные функции в организме, среди которых следует отметить использование их клетками для синтеза ряда биологически активных веществ (адреналина, тироксина).
Триптофан (Три, W) - a-амино-b-индолилпропионовая кислота. Используется для синтеза витамина PP, серотонина, гормонов эпифиза.
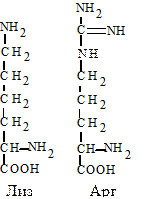 |
Гистидин (Гис, H) - a-амино-b-имидазолилпропионовая кислота. Может использоваться при образовании гистамина, регулирующего проницаемость тканей и проявляющего свое действие при аллергии.
7. Диаминомонокарбоновые аминокислоты. Лизин (Лиз, K) - диаминокапроновая кислота. Аргинин (Арг, R) - a-амино-b-гуанидин-валериановая кислота. Эти аминокислоты имеют дополнительную аминогруппу, которая придает основные свойства белкам, содержащим много таких аминокислот. Образование аргинина является частью метаболического пути обезвреживания аммиака (синтез мочевины).
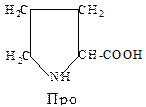 |
8. Иминокислота - пролин (Про, P). Отличается от других аминокислот по строению. Её радикал образует с a-аминогруппой единую циклическую структуру. Благодаря этой особенности вокруг связи между a-аминогруппой и a-углеродным атомом невозможно никакое вращение. У всех других аминокислот возможность вращения вокруг этой связи имеется. Вдобавок в состав пролина входит вторичная аминогруппа (с азотом азота связан только один атом водорода), которая отличается, по своим химическим характеристикам от первичной аминогруппы (-NH2) в составе других аминокислот. Особое место отводится этой аминокислоте в структуре коллагена, где пролин, в процессе синтеза коллагена, может превращаться в гидроксипролин.
В скобках указаны сокращенные обозначения аминокислот, которые образуются из первых трех букв их тривиального названия. В последнее время для записи первичной структуры используются и однобуквенные символы, что важно при использовании ЭВМ в работе с белками.
 2015-10-16
2015-10-16 1784
1784
