Задание. Решите задачи своего варианта (табл. 32).
Таблица 32
Исходные данные
| Вариант | Условия |
| 1. Объясните, что определяет межъядерное расстояние. Почему при сближении атомов их ядра не сливаются? | |
| 2. Что такое связующие и разрыхляющие молекулярные орбитали? Каковы энергии электронов на них по сравнению с энергиями на исходных атомных орбиталях? Какая из частиц He или He+2 более устойчива? Объясните причину устойчивости с точки зрения метода молекулярных орбиталей. | |
| 1. Изобразите все возможные способы перекрывания s-орбитали с р-орбиталью; двух р-орбиталей. Укажите направленность связи при этом, а также обозначьте δ- и π-связи. | |
| 2. Молекула СО2 имеет нулевое значение дипольного момента. Предложите структурно-графическую формулу углекислого газа. Чем объяснить, что у структуры СОCl2 величина дипольного момента отлична от нуля? | |
| 1. Почему использование гибридных орбиталей предпочтительнее, чем обычных (негибритизованных) при образовании химической связи? | |
| 2. Что такое диамагнетизм и парамагнетизм? Какие молекулы обладают диамагнитными свойствами, а какие парамагнитными? Объясните парамагнитные свойства молекулы кислорода с позиций метода МО. Возможно ли это сделать с помощью метода ВС? | |
| 1. Чем отличается ионная связь от ковалентной? Приведите примеры соединений с такими связями. | |
| 2. Составьте энергетическую диаграмму молекулы HF. Почему возможно образование молекулярной орбитали за счет атомных орбиталей с разным значением главного квантового числа? | |
| 1. Напишите электронные конфигурации основных и возбужденных состояний атомов В, Р, Si. | |
| 2. Нарисуйте энергетическую схему образования молекулы азота по методу молекулярных орбиталей (ММО). Сколько электронов находится на связывающих и разрыхляющих орбиталях? Чему равен порядок связи в этой молекуле? | |
| 1. Предскажите геометрию молекул CF4, SiH4, PH3. | |
| 2. Нарисуйте энергетическую схему образования молекулы фтора по методу молекулярных орбиталей. Сколько электронов находится на связывающих и разрыхляющих орбиталях? Чему равен порядок связи в этой молекуле? | |
| 1. Существует ли аналогия в строении молекул Н2О и H2S, PH3 и NH3, LiCl и HCl? Ответ обоснуйте. | |
| 2. Нарисуйте энергетическую схему образования молекулы кислорода по методу молекулярных орбиталей. Как метод МО объясняет парамагнитные свойства молекулы кислорода? |
Продолжение табл. 32
| Вариант | Условия |
| 1. Объясните донорно-акцепторный механизм ковалентной связи на примере образования иона фосфония [РН4]+. | |
2. Нарисуйте энергетическую схему образования молекулярного иона  и молекулы Н2 по методу молекулярных орбиталей. Где энергия связи больше? Почему? и молекулы Н2 по методу молекулярных орбиталей. Где энергия связи больше? Почему? | |
| 1. Какие из двух элементов образуют соединения с преобладанием ионной или ковалентной связей: а) рубидий с фтором; б) водород с фтором; в) водород с углеродом? | |
| 2. Какие электроны атома бора участвуют в образовании ковалентных связей? Как метод валентных связей объясняет симметричную треугольную форму молекулы ВF3? | |
| 1. Определите взаимосвязь между такими параметрами, как направленность связи и гибритизация орбиталей, направленность связи и валентный угол, энергия связи и полярность, энергия связи и гибритизация орбиталей. | |
| 2. Почему Н2О и HF, имея меньшую молекулярную массу, плавятся и кипят при более высоких температурах, чем их аналоги? | |
| 1. В молекулах СО, СО2, HBr, Br2 связь полярная или неполярная? Объясните. | |
2. Нарисуйте энергетическую схему образования молекулы Не2 и молекулярного иона  по методу молекулярных орбиталей. Как метод МО объясняет устойчивость иона по методу молекулярных орбиталей. Как метод МО объясняет устойчивость иона  и невозможность существования молекулы Не2? и невозможность существования молекулы Не2? | |
| 1. Почему некоторые молекулы, имеющие полярные связи, в целом являются неполярными? | |
| 2. Какая из частиц в ряду Ве+2 – Ве2 – Ве–2 наиболее устойчива? Каков порядок связи в этих частицах? | |
| 1. Почему в галогенидах щелочных металлов формируется ионная связь? | |
| 2. Составьте энергетические диаграммы молекулярных орбиталей молекул азота и оксида углерода (II). Что общего у этих молекул? | |
| 1. Объясните причины и приведите примеры сходства и отличия ионной связи от ковалентной. | |
| 2. Как метод валентных связей (ВС) объясняет угловое строение молекулы H2S и линейное молекулы СО2? | |
| 1. Ковалентный или ионный тип связи характерен для следующих соединений: NaJ, SO2, KF, CO2? | |
| 2. Исходя из значений электроотрицательности атомов соответствующих элементов, определите, какая из связей: HCl, JCl, BrF наиболее полярна. | |
| 1. Почему ионная связь считается предельным случаем ковалентной? | |
| 2. Как метод валентных связей (ВС) объясняет линейное строение молекулы BeCl2 и тетраэдрическое СН4? |
Продолжение табл. 32
| Вариант | Условия |
| 1. Почему при растворении HCl в воде образуются ионы, хотя связь в молекуле не ионная? | |
| 2. Сколько неспаренных электронов имеет атом хлора в нормальном и возбужденном состояниях? Распределите эти электроны по квантовым ячейкам. Чему равна валентность хлора, обусловленная неспаренными электронами? | |
| 1. Почему молекула Cl2 неполярная, а JCl полярная? | |
| 2. Что называют электрическим моментом диполя? Какая из молекул HCl, HBr, HJ имеет наибольший момент диполя? Почему? | |
| 1. Почему в металлах химическая связь делокализована? | |
| 2. Распределите электроны атома серы по квантовым ячейкам. Сколько неспаренных электронов имеют ее атомы в нормальном и возбужденном состояниях? Чему равна валентность серы, обусловленная неспаренными электронами? | |
| 1. В чем сходство и отличие водородной связи от других видов связи. Приведите примеры веществ с водородной связью. | |
| 2. Какие типы гибритизации АО углерода соответствуют образованию молекул СН4, С2Н6, С 2Н4, С2Н2? | |
| 1. Напишите электронные формулы молекул азота и кислорода. | |
| 2. В молекулах SO2 и SO3 атом серы находится в состоянии sp2-гибридизация. Полярны ли эти молекулы? Какова их пространственная структура? | |
| 1. Какая химическая связь называется ионной? Чем определяется величина положительной валентности элементов, участвующих в образовании ионной связи? | |
| 2. Почему отрыв одного электрона от молекулы СО приводит к ослаблению связи, а от молекулы NO – к ее усилению? | |
| 1. Между атомами каких элементов возникает ионная связь? Чем определяется величина отрицательной валентности? | |
| 2. Перечислите основные положения метода молекулярных орбиталей (ММО). Напишите электронную формулу молекулы азота и определите в ней порядок связи. | |
| 1. Как влияет водородная связь на температуру кипения и плавления? | |
| 2. Почему молекула CF4 имеет тетраэдрическую,COF2 – треугольную, a CO2 – линейную формы? Каково гибридное состояние валентных орбиталей атома углерода в данных молекулах? | |
| 1. Какие молекулы называются полярными, неполярными? Чем объясняются случаи, когда молекулы, имеющие поляризованные связи, являются неполярными? | |
| 2. Молекула BF3 имеет плоскостную структуру, а NF3 – объемную (пирамидальную). В чем причина различия в строении молекул? | |
| 1. Приведите примеры образования ковалентной связи по донорно-акцепторному механизму. | |
| 2. Какую химическую связь называют ионной? Как она образуется и какими свойствами обладает? На основе разности относительных электроотрицательностей атомов элементов укажите, как изменяется степень ионности в соединениях HF, HCl, HBr, HI. |
Окончание табл. 32
| Вариант | Условия |
| 1. Что называется диполем, дипольным моментом? Что характеризует величина дипольного момента? | |
| 2. Какой тип связи осуществляется в кристаллах металлов? Каковы особенности этого типа связи? | |
| 1. Одинакова ли геометрическая конфигурация молекул BF3 и NF3. Ответ обосновать. | |
| 2. Сравните способы образования ковалентных связей в молекуле NH3 и в ионе NH+4. | |
| 1. Изобразите перекрывание электронных орбиталей у молекул F2, HF, H2S, PH3. Какую форму должна иметь молекула PH3? | |
| 2. В каком из приведенных соединений: LiF, BeF2, BF3, CF4 связь Э-F будет больше всего приближаться к ковалентной? | |
| 1. Охарактеризуйте ван-дер-ваальсовые силы. Какое взаимодействие молекул называют ориентационным, индукционным, дисперсионным? Как влияет на ориентационное взаимодействие повышение температуры? | |
| 2. Какую ковалентную связь называют d-, p-, s-связью? Как метод ВС объясняет строение молекулы азота? |
Тестовые задания
1. Перекрывание облаков вдоль линии соединения атомов, называется:
а) π-связь
б) δ-связь
в) р-связь
г) sр-гибритизация
2. Ковалентной связью по донорно-акцепторному механизму называется связь, образованная:
а) парой электронов с антипараллельными спинами и принадлежащим двум атомам
б) атомами, резко отличающимися друг от друга величинами электроотрицательности
в) за счет электронного облака одного атома и свободной орбитали другого
г) ионами, связанными друг с другом обобществленными электронами
3. Металлической связью называется связь, образованная:
а) парой электронов с антипараллельными спинами и принадлежащим двум атомам
б) атомами, резко отличающимися друг от друга величинами электроотрицательности
в) за счет электронного облака одного атома и свободной орбитали другого
г) ионами, связанными друг с другом обобществленными электронами
4. Ковалентная связь образуется электронами, спины которых:
а) одинаковы
б) противоположны
в) параллельны
г) равноценны
5. Полярность ковалентной связи между атомами тем выше, чем больше разница между атомами в величине__________
6. Ионной связью называется связь, образованная:
а) парой электронов с антипараллельными спинами и принадлежащим двум атомам
б) атомами, резко отличающимися друг от друга величинами электроотрицательности
в) за счет электронного облака одного атома и свободной орбитали другого
г) ионами, связанными друг с другом обобществленными электронами
7. Наиболее прочная связь в молекуле
а) 
б) 
в) 
г) 
8. Наиболее прочная и короткая связь в молекуле
а) 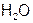
б) 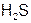
в) 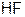
г) 
9. Вещества с полярной ковалентной связью – это
а) 
б) 
в) 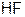
г) 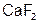
10. Химическая связь в соединении 
а) неполярные ковалентные
б) полярные ковалентные
в) преимущественно ионные
г) ковалентные и ионные.
 2015-10-22
2015-10-22 2951
2951








