И термодинамика
Сыктывкар 2008
Рекомендовано к изданию на заседании кафедры физики КГПИ 26.11.2008 г., протокол № 3.
Молекулярная физика и термодинамика: Лабораторный практикум / сост. Турьев А.В., Павлова Н.И. – Сыктывкар: изд-во Коми пед. ин-та, 2009. 52 с.
В пособии представлены материалы для проведения лабораторных занятий, включающие руководство для выполнения лабораторных работ по основным темам молекулярной физики и термодинамики.
Трудно переоценить значимость физического эксперимента в углублении представлений закономерностей физических явлений и изучении основных законов. лабораторные работы являются важным звеном в цепи формирования понятий физики для будущего учителя. Практикум предназначен для студентов физико-математического факультета.
Ó Коми государственный педагогический институт, 2009
ПРЕДИСЛОВИЕ
Цель данного методического пособия заключается в том, чтобы позволить студенту самому воспроизвести основные физические явления, научить его обращению с основными измерительными приборами и познакомить с важнейшими методами измерений. Не менее существенно приобрести и закрепить навыки оформления лабораторных работ, построения графиков, а также оценки достоверности полученных результатов (сравнение своих результатов с табличными значениями, где это возможно), умения правильно оценить точность полученных значений. Получение надежных числовых значений физических величин вовсе не является простой задачей из-за многочисленных погрешностей, неизбежно возникающих при измерениях. Необходимо познакомиться с погрешностями и с методами, применяемыми при обработке результатов, полученных при измерениях. Владение этими методами нужно для того, чтобы научиться получать из совокупности измерений наиболее близкие к истине результаты, вовремя заметить несоответствия и ошибки, разумно оценить точность полученных значений.
Основная трудность при проведении лабораторных работ состоит в том, что возникает некоторый разрыв между сроками выполнения работ и прослушиванием студентами соответствующих разделов лекционного курса. Лабораторные занятия достигают своей цели только тогда, когда учащиеся, приступая к выполнению работы, будут ясно представлять себе исследуемое в ней физическое явление или закон. Это требует большой самостоятельной работы по подготовке к каждому занятию. Чтобы помочь студентам, каждой работе предшествует небольшое теоретическое введение. Введение позволяет лучше ориентироваться в учебной литературе. Объем сведений, излагаемый во введении, не освобождает от необходимости проработки соответствующих разделов учебной литературы, рекомендуемой к данной работе.
Описания к работам содержат теоретическую часть (введение), описание экспериментальной установки. Затем следуют задания, показывающие последовательность работы при проведении измерений. Они составлены так, чтобы было понятно существо изучаемого явления. После описаний приводятся списки контрольных вопросов для обеспечения самоконтроля студентов за самостоятельной подготовкой к лабораторной работе, для лучшего усвоения сущности применяемого ими метода измерений и глубокого осмысления полученных в работе результатов.
Лабораторная работа № 1
ОПРЕДЕЛЕНИЕ ПОСТОЯННОЙ БОЛЬЦМАНА
И ЧИСЛА АВОГАДРО
МЕТОДОМ БРОУНОВСКОГО ДВИЖЕНИЯ
Цель работы: Экспериментальное определение постоянной Больцмана и числа Авогадро.
Введение
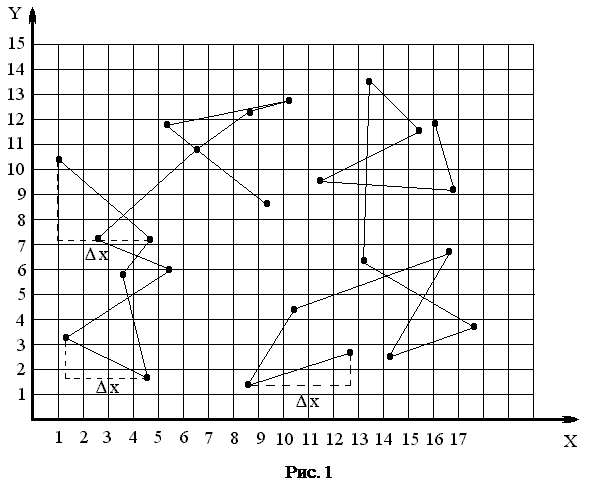
Броуновское движение – непрерывное, беспорядочное перемещение малых частичек вещества, взвешенных, в жидкости или газе – представляет собой одно из наиболее ярких и доступных наблюдению проявлений молекулярно-кинетического движения. Движение броуновских частиц можно наблюдать через микроскоп. Если отмечать положение частицы через равные промежутки времени D t, то получится картина, изображенная на рис. 1.
Хаотическое движение броуновских частиц подчиняется статистическим закономерностям. Среднее значение квадрата смещения частицы за промежутки времени D t вдоль оси х (или любой другой оси) пропорционально этому промежутку времени и, как показал А. Эйнштейн, определяется формулой:
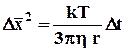 , (1)
, (1)
где k – постоянная Больцмана;
r – радиус броуновской частицы;
h –коэффициент вязкости жидкости, где двигаются броуновские частицы.
Формула (1) используется в этой работе для определения постоянной Больцмана k:
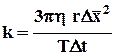 (2)
(2)
Постоянная Больцмана k является очень важной физической постоянной, необходимой для расчета многих величин в различных областях физики и химии и может быть определена различными методами. Здесь эта величина определяется методом наблюдения броуновского движения.
Постоянная Больцмана k может быть выражена через число Авогадро NA и универсальную газовую постоянную R следующим образом:
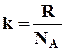 (3)
(3)
Универсальная газовая постоянная может быть определена независимо от данного метода и поэтому формула (1) позволяет вычислить число Авогадро:
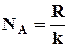 (4)
(4)
В данной работе ставится задача экспериментального определения постоянной Больцмана k. Используя известное табличное значение универсальной газовой постоянной R,по формуле (4) определяют число Авогадро NA.
Описание установки
Принадлежности:
1. Микроскоп МБР-1 с осветителем;
2. Тонкая стеклянная кювета;
3. Покровные стекла;
4. Секундомер;
5. Пипетка;
6. Эмульсия;
7. Стекло с сеткой;
8. Линейка с делениями по 0,01 мм.
Установка состоит из микроскопа МБР-1 с осветителем и тонкой стеклянной кюветы с исследуемой эмульсией.
Один из способов приготовления эмульсии заключается в следующем: 1 см3 2 % раствора канифоли в спирте вливают каплями в 30 см3 воды при тщательном помешивании. Нерастворимая в воде канифоль образует при этом молочно-белую эмульсию с частицами шарообразной формы и приблизительно одинакового размера.
Выполнение работы
1. Взять кювету. Пипеткой наполнить кювету эмульсией, затем накрыть кювету покровным стеклом так, чтобы под стеклом не образовались пузырьки воздуха.
2. Подготовить к работе микроскоп. Включить его в сеть, отрегулировать яркость (поставить на минимум освещенность). Винт точной наводки отрегулировать так, чтобы он работал только на подъем.
3. Поставить кювету с эмульсией на предметный столик микроскопа. Подвести объектив микроскопа к кювете как можно ближе винтом грубой наводки.
4. Пользуясь винтом точной наводки, сфокусировать микроскоп на объект. Фокусировать нужно осторожно, чтобы не повредить покровное стекло.
5. Обнаружив броуновские частицы, вставить в окуляр стекло с сеткой и наблюдать броуновское движение частицы.
6. Через каждые D t = 10 с фиксировать значение координаты х броуновской частицы (зафиксировать не менее 50 значений).
Обработка результатов
Как следует из (3), среднее значение квадрата смещения броуновской частицы пропорционально промежутку времени D t. Это положение теории нужно проверить в первую очередь. Пусть, например, ваши данные выглядят так: значения х через каждые 10 секунд: 21; 22; 22,5; 23; 23,5; 24,5; 25; 23,5; 24; 22,5; 21,5; 20; 21; 21; 22; 22,5; 23; 23,5; 24,5; 25; 23,5; 24; 22,5; 21,5; 20; 21; 20; 21; 20; 18; 18; 15,5; 14,5; 14,5; 14,5; 15; 15,5; 14,5; 14,5; 12; 12,5, 12, 11,5, 12,5, 12,5; 10; 10,5; 10,5; 10; 10,5; 10; 8; 8,5; 8; 8; 8; 8; 8; 7; 6; 7,5; 6,5; 6; 6,5;
Итого сделано 56 измерений. Определим все D х, т. е. расстояния между соседними частицами и возведем их в квадрат. Получим:
| D х | D х2 | D х | D х2 | D х | D х2 | |
| 1,0 0,5 0,5 0,5 0,5 1,0 0,5 0,5 0,5 1,5 1,0 1,0 2,0 2,5 1,0 0,5 0,5 | 1,0 0,25 0,25 0,25 0,25 1,0 0,25 0,25 0,25 2,25 1,0 1,0 4,0 6,25 1,0 0,25 0,25 | 0,5 0,5 1,0 2,0 0,5 0,5 1,0 0,5 0,5 1,5 0,5 0,5 0,5 2,0 0,5 | 0,25 0,25 1,0 4,0 0,25 0,25 1,0 0,25 0,25 2,25 0,25 0,25 0,25 4,0 0,25 | 1,0 1,0 1,0 0,5 0,5 0,5 1,5 0,5 0,5 1,0 1,0 1,5 | 1,0 1,0 1,0 0,25 0,25 0,25 2,25 0,25 0,25 1,0 1,0 2,25 50,75 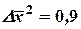 | |
Среднее значение D х 2 за промежуток времени D t = 10 с получается:
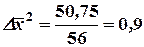 кв.кл.
кв.кл.
Таким образом, среднее значение квадрата смещения, действительно, приблизительно пропорционально промежутку времени D t. Определим среднее значение D х 2 за D t = 20 с. Для этого записываем координаты, соответствующие времени: 0, 20, 40, 60 с и т. д., и из них вычисляем Dх2. Убеждаемся, что D х 2 ~ D t.
Определим постоянную Больцмана k по формуле (2). Коэффициент вязкости h = 10–3 Па.с. Температура комнатная (Т), Dх2 берется из опыта, средний радиус броуновской частицы r, который равен около 0,001 мм. Значение D х 2 получается не в абсолютных единицах, а в квадратных клетках сетки, расположенной в окуляре. Чтобы определить абсолютное значение, необходимо определить цену деления одной клетки сетки. Для этого служит линейка с ценой деления 0,01 мм.
Примечание. Радиус частицы r был определен экспериментально следующим образом: каплю эмульсии наносят на стекло и дают просохнуть на воздухе. После чего накрывают ее покровным стеклом. При высыхании среды зерна эмульсии объединяются цепочками, ими плотно покрывается участок поля. Поэтому можно подсчитать число зерен, имеющихся на стороне квадрата сетки. Определение радиуса броуновской частицы является довольно трудной задачей и поэтому его определение в данной работе не обязательно (r = 0,001 мм).
Контрольные вопросы
1. Как объяснить броуновское движение?
2. Физический смысл постоянной Больцмана и числа Авогадро.
3. Вывести формулу Эйнштейна.
4. Как проверить, что D х 2 ~ D t?
5. Как можно другими способами определить число Авогадро?
Литература
1. Кикоин А.К., Кикоин И.К. Молекулярная физика. – Любое издание.
Лабораторная работа № 2
ОПРЕДЕЛЕНИЕ МАССЫ МОЛЕКУЛЫ ЭФИРА
Цель работы: определение массы молекулы эфира экспериментально.
Введение
Молекулярно-кинетическая теория (МКТ) основывается на трех основных положениях:
1) всякое вещество состоит из частиц – атомов, молекул, ионов;
2) атомы, молекулы и ионы находятся в непрерывном хаотическом движении;
3) между частицами существуют силы взаимодействия – притяжения и отталкивания.
С точки зрения молекулярно-кинетической теории, давление – это средняя величина, результат большого числа соударений молекул об стенку сосуда. Такие средние величины, как давление, температура характеризуют движение и взаимодействие огромной совокупности частиц.
Создателем МКТ газов считается австрийский ученый Людвиг Больцман (1844–1906). Он ввел в физику представление о том, что макроскопический параметр газа – температура (Т) – является мерой энергии кинетического движения частиц. Легко измеряемая температура дает нам наглядное представление об энергии, с которой движутся невидимые мельчайшие частицы.
P = nkT; 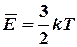
В данных уравнениях постоянная Больцмана k как бы связывает характеристики микромира (средняя кинетическая энергия частиц E) и характеристики макромира (давление газа Р и его температуру Т). Молекула – это наименьшая частица вещества, сохраняющая все его свойства. В данной работе определяется одна из важнейших характеристик молекулы – масса молекулы (m 0 ). Массу молекул нельзя измерить непосредственно, т. к. размеры атомов примерно 10-10 м, а величина массы примерно 10-27 кг.
Описание экспериментальной установки и эксперимента
Экспериментальная установка изображена на рис.1. Стеклянный сосуд закрыт пробкой, через которую проходит стеклянная трубка, с помощью
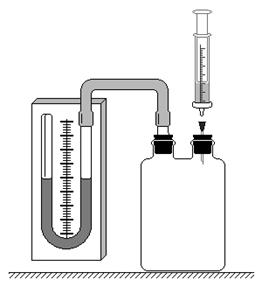 Рис.1
Рис.1
резинового шланга соединенная с жидкостным манометром. Через вторую пробку проходит игла от шприца. С помощью шприца в сосуд вводят некоторое количество эфира, который быстро испаряется, образуя ненасыщенные пары. К ним можно применить законы идеального газа.
Плотность газа по определению находится по формуле:
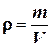 (1)
(1)
где m – масса газа, а V – объем сосуда.
Также плотность газа можно найти, зная массу одной молекулы m 0 и количество молекул в единице объема n, т. е. r = m 0 n (2).
Приравнивая правые части равенств (1) и (2), получим формулу для нахождения массы m 0 молекулы эфира:
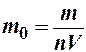 (3)
(3)
Концентрацию (n) молекул можно определить, используя основное уравнение МКТ: Р = nkT, из которого следует:
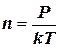 (4)
(4)
где P – парциальное давление газообразного эфира;
k – постоянная Больцмана;
Парциальное давление эфира в нашей установке уравновешивается давлением столбика жидкости h в манометрической трубке, т. е .:
P = rвg h,
где rв – плотность жидкости (воды) в манометре;
g – ускорение свободного падения;
h – разность уровней в манометре.
Тогда формулу (4) можно записать в виде:
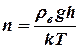 (5)
(5)
Выразив массу паров эфира через плотность и объем введенного в сосуд жидкого эфира, из формулы (4) и (5) определяют массу одной молекулы:
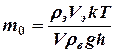 (6)
(6)
(Нужно иметь в виду, что массы молекул жидкого и газообразного эфира равны).
Выполнение работы
Набрать в шприц 0,3 см3 жидкого эфира и впрыснуть его в колбу. По показанию манометра определить парциальное давление паров эфира. По формуле (6) вычислить массу молекулы эфира. Проделать опыт 2-3 раза. Все измерения занести в таблицу.
Таблица
| № пп | V, м3 | Vэ, м3 | H, м | m 0, кг | m 0ср, кг | D m, кг | D m 0ср, кг |
| 1. 2. |
Результат представить в виде: m0 = m0ср ± Dmср
Абсолютные погрешности находятся по формулам:
D m 1 = | m 0ср – m 01 |
D m 2 = | m 0ср – m 02 |
V =1,326 л = 1,326 10-3 м3 (объем сосуда);
k = 1,38 10-23 Дж/град(постоянная Больцмана);
r э = 0,7.103 кг/м3(плотность эфира)
Контрольные вопросы
1. Чему равна масса одного моля воды, одной молекулы воды?
2. Основные положения МКТ газов и их обоснование.
3. Основное уравнение МКТ газов (различные формы).
4. Газовые законы (Дальтона, Авогадро).
5. Распределение молекул по скоростям (распределение Максвелла).
Литература
1. Яковлев А. Курс физики. Теплота и молекулярная физика.
2. Кикоин А.К., Кикоин И.К. Молекулярная физика. Любое издание.
Лабораторная работа № 3
ИЗУЧЕНИЕ ПЕРЕХОДА:
ТВЕРДОЕ ВЕЩЕСТВО - ЖИДКОСТЬ,
ЖИДКОСТЬ – ТВЕРДОЕ ВЕЩЕСТВО
Цель работы: Изучение процессов плавления и кристаллизации.
Введение
Все твердые тела можно разделить на кристаллические и аморфные. Одной из их важных отличительных особенностей, является наличие определенной температуры плавления и отвердевания, что связано с различным внутренним строением этих тел.
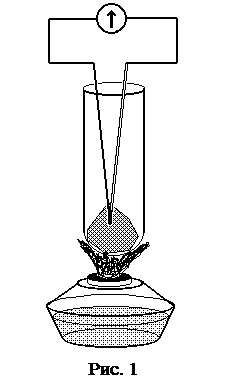 Поместим кусок твердого тела (например, металл) в пробирку и будем нагревать ее. Температуру тела измерим термопарой (рис. 1). С течением времени температура твердого тела непрерывно растет, как показано на рис. 2. По достижении некоторой характерной для данного вещества температуры, называемой температурой плавления, тело начинает плавиться и при дальнейшем нагревании температура его остается постоянной. Все подводимое при этом тепло тратится на плавление твердого тела. Температура смеси твердого тела с его расплавом остается постоянной, равной температуре плавления до тех пор, пока все твердое тело не превратится в жидкость. При дальнейшем нагревании температура жидкости начнет расти (рис. 2).
Поместим кусок твердого тела (например, металл) в пробирку и будем нагревать ее. Температуру тела измерим термопарой (рис. 1). С течением времени температура твердого тела непрерывно растет, как показано на рис. 2. По достижении некоторой характерной для данного вещества температуры, называемой температурой плавления, тело начинает плавиться и при дальнейшем нагревании температура его остается постоянной. Все подводимое при этом тепло тратится на плавление твердого тела. Температура смеси твердого тела с его расплавом остается постоянной, равной температуре плавления до тех пор, пока все твердое тело не превратится в жидкость. При дальнейшем нагревании температура жидкости начнет расти (рис. 2).
Если нагревание прекратить, жидкость начнет охлаждаться и температура ее с течением времени начнет уменьшаться, как показано на рис. 3. При достижении температуры плавления жидкость должна начать кристаллизоваться. Но если в жидкости нет центров кристаллизации, то кристаллизация затруднена и вещество, оставаясь в жидком состоянии, остынет до температуры меньше, чем температура плавления. Такое состояние называется переохлаждением. Величина переохлаждения для металла незначительна и составляет обычно доли градусов. Для гипосульфита переохлаждение может достигнуть и десятка градусов. Если в переохлажденной жидкости создать центр кристаллизации (например, бросив туда кристаллы этого же вещества), то часть жидкости начнет кристаллизоваться. Температура смеси начнет при этом повышаться. Причина повышения температуры смеси следующая: внутренняя энергия кристаллического состояния всегда меньше, чем внутренняя энергия жидкости. Следовательно, при переходе из жидкого состояния в твердое – внутренняя энергия уменьшается, и освобожденная энергия распределяется по всей массе смеси, повышая температуру. При дальнейшем охлаждении температура закристаллизовавшегося вещества будет уменьшаться.
В противоположность кристаллическим телам, аморфные тела не имеют определенной температуры плавления (отвердевания). Они переходят в жидкое состояние плавно, без скачков, постепенно размягчаясь. Таким образом, принципиальной разницы между жидким и твердым состоянием аморфного вещества нет.

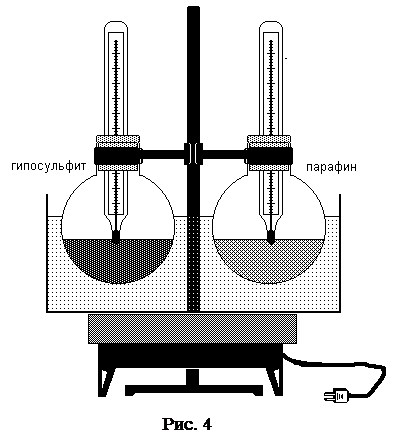
Выполнение работы
Необходимо провести наблюдение за температурой при переходе из твердого состояния в жидкое и из жидкого состояния в твердое для двух веществ: аморфного и кристаллического.
Имеются две колбы, в левой колбе помещено кристаллическое вещество – гипосульфит, а в правой – аморфное вещество – парафин. В каждой колбе находится термометр для регистрации изменения температуры при нагревании и охлаждении. Время фиксируется с помощью секундомера.
1. Поместить колбы в сосуд с водой и поставить на электроплитку.
2. Электроплитку включить в сеть.
3. С помощью секундомера через каждые две минуты фиксировать показания термометров.
4. Данные записать в таблицу:
| Гипосульфит | Парафин | ||
| время | температура | время | температура |
5. После того как оба вещества перейдут в жидкое состояние, электроплитку отключить из сети. Убрать сосуд с водой.
6. Фиксировать показания термометров и секундомера при охлаждении. Когда температура гипосульфита опустится на 2–3 градуса ниже температуры плавления (Т пл = 48 0С), в колбу необходимо бросить кристаллики гипосульфита, через отверстие в пробке. Затем продолжить наблюдение за температурой, пока температура не пройдет через максимум (Т пл = 48 0С) и не опустится на несколько градусов ниже этого максимума.
7. Построить график зависимости температуры от времени для двух веществ по полученным данным, затем сравнить с теоретическим.
Контрольные вопросы
1. Какие различия между аморфными и кристаллическими веществами?
2. Объясните различия между аморфными и кристаллическими веществами с точки зрения МКТ.
3. Что такое «переохлаждение»?
4. Почему при кристаллизации «переохлажденного» вещества его температура повышается?
5. Что называют удельной теплотой плавления?
6. Как находится количество теплоты?
Литература
1. Кикоин А.К., Кикоин И.К. Молекулярная физика. Любое издание.
2. Зисман Тодес. Курс общей физики. Молекулярная физика и теплота.
3. Ландсберг Г.С. Элементарный учебник физики.
Лабораторная работа № 4
ИЗУЧЕНИЕ КОЭФФИЦИЕНТА ПОВЕРХНОСТНОГО
НАТЯЖЕНИЯ
Цель работы: определение коэффициента поверхностного натяжения воды и его зависимости от температуры.
Введение
Между молекулами жидкости существуют силы притяжения, которые действуют на очень маленьком расстоянии r (порядка 10-9 м). Это расстояние r называется радиусом молекулярного действия. Сфера вокруг центра молекулы радиусом r называется сферой молекулярного действия. Внутри сферы находится множество других молекул, которые взаимодействуют с молекулой М.
Если молекула М 1 находится внутри жидкости (рис. 1) и сфера молекулярного взаимодействия лежит целиком под поверхностью жидкости, то вследствие статистической закономерности симметрии расположения всех других взаимодействующих молекул, равнодействующая сил взаимодействия равна нулю! Таким образом, внутри жидкости не будет проявляться действие этих сил.
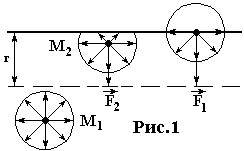 Если же молекула находится на границе с какой-либо средой, например, с воздухом, с паром жидкости, стенками сосуда и т. д., то симметрия нарушается. Молекула на границе находится совершенно в других условиях, нежели молекула внутри жидкости (рис. 1).
Если же молекула находится на границе с какой-либо средой, например, с воздухом, с паром жидкости, стенками сосуда и т. д., то симметрия нарушается. Молекула на границе находится совершенно в других условиях, нежели молекула внутри жидкости (рис. 1).
Рассмотрим молекулу М 2, которая находится на расстоянии от поверхности, меньшем чем r. Так как плотность воздуха во много раз меньше плотности жидкости, то выступающая за пределы жидкости часть сферы молекулярного действия будет менее заполнена молекулами, чем остальная часть сферы. В результате на каждую молекулу, находящуюся в поверхностном слое толщиной r, будет действовать сила, направленная внутрь жидкости. Величина этой силы растет в направлении от внутренней к наружной границе слоя. Молекулы в поверхностном слое обладают дополнительной потенциальной энергией.
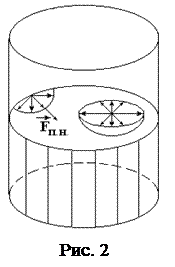 Молекулы жидкости стремятся уйти с поверхностного слоя внутрь жидкости. Уменьшение числа молекул в поверхностном слое жидкости может произойти только при уменьшении ее поверхности. Поэтому вся жидкость стремится сократить свою поверхность. Поверхностный слой как бы стремится внутрь жидкости и на ее поверхности образуется, таким образом, как бы упругая пленка. Это явление называется поверхностным натяжением.
Молекулы жидкости стремятся уйти с поверхностного слоя внутрь жидкости. Уменьшение числа молекул в поверхностном слое жидкости может произойти только при уменьшении ее поверхности. Поэтому вся жидкость стремится сократить свою поверхность. Поверхностный слой как бы стремится внутрь жидкости и на ее поверхности образуется, таким образом, как бы упругая пленка. Это явление называется поверхностным натяжением.
Лежащие в поверхностном слое молекулы притягиваются не только молекулами, расположенными ниже их, но и своими соседями (рис. 2). В результате этого в поверхностном слое возникает сила поверхностного натяжения, для количественной характеристики которой вводят коэффициент поверхностного натяжения (s). Его можно ввести двояко: с энергетической точки зрения и с силовой.
Коэффициент поверхностного натяжения (s) – величина, численно равная работе, необходимой для изменения площади поверхности жидкости на единицу.
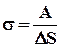
Коэффициент поверхностного натяжения (s) – величина, численно равная силе, действующей вдоль поверхности жидкости на единицу длины поверхности жидкости.

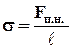

Для определения коэффициента поверхностного натяжения существует несколько способов:
1. Определение (s) способом отрыва.
2. Определение (s) по методу максимального давления в пузырьке.
3. Определение коэффициента (s) способом капель.
Определение коэффициента поверхностного натяжения
способом капель
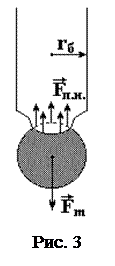
Экспериментальная установка состоит из бюретки с радиусом r б = 1 мм. На бюретке нанесена шкала c ценой деления 0,1 миллилитра, по которой можно определить объем вытекающей жидкости. В СИ 1 мл = 1. 10-6 м3.
На рис. 3 показан процесс образования капли в бюретке. Перед отрывом капли образуется шейка, радиус которой примерно равен 0,9 радиуса бюретки (r ш = 0,9 r б). Вдоль окружности этой шейки и действует сила поверхностного натяжения жидкости F п.н ., которая в момент отрыва равна силе тяжести F m .
 F m = F п.н.
F m = F п.н.
m кg = 2p r шs,
где m к – масса одной капли.
Массу капли можно выразить через плотность воды rв и объем одной капли V к.
m к = rв V к
Объем одной капли можно определить экспериментально, зная объем вытекшей воды V и количество капель N.
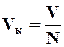
Тогда, используя полученные выражения, можно выразить s.
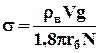 (1)
(1)
Задание 1
1. С помощью крана бюретки установить течение воды по каплям.
2. Зафиксировать начальный объем жидкости по шкале и начать отсчет капель N.
3. Отсчитать порядка 50-100 капель, зафиксировать конечный объем воды.
4. По формуле (1) найти s.
5. Провести эксперимент три раза и получить средний результат.
Изучение зависимости коэффициента поверхностного натяжения
воды от температуры методом максимального давления в пузырьке
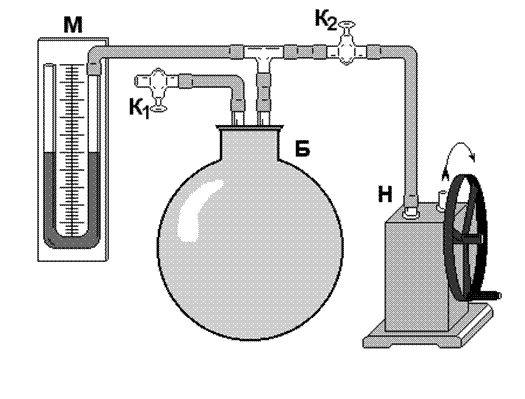
На рис. 4 изображена схема прибора Ребиндера. Исследуемая жидкость (вода) наливается в пробирку В. Через пробку этой пробирки проходит стеклянная трубка С, нижний конец которой оттянут и касается жидкости, а верхний конец соединен с атмосферой.
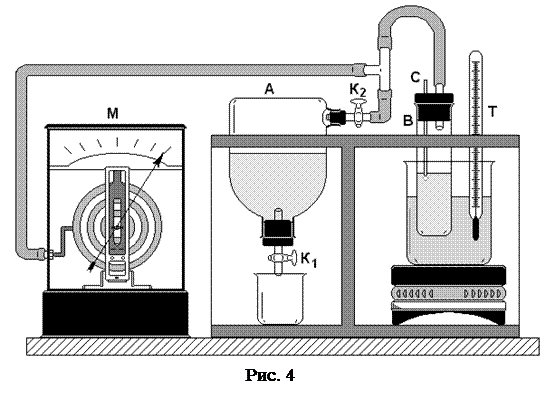
 С помощью сосуда А (аспиратора), из которого при приоткрытом кране К1 по каплям вытекает вода, в пробирке В создается разрежение. По мере вытекания воды из аспиратора, давление в пробирке В постепенно понижается. Разность давления DP внутри и вне пробирки В приводит к возникновению на нижнем конце трубки С воздушного пузырька.
С помощью сосуда А (аспиратора), из которого при приоткрытом кране К1 по каплям вытекает вода, в пробирке В создается разрежение. По мере вытекания воды из аспиратора, давление в пробирке В постепенно понижается. Разность давления DP внутри и вне пробирки В приводит к возникновению на нижнем конце трубки С воздушного пузырька.
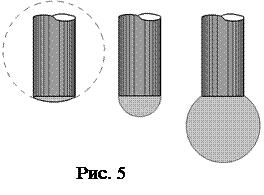
Так как увеличивается D P, то и пузырек постепенно увеличивается, причем его радиус кривизны, как видно из рис. 5, вначале уменьшается, а растущая разность давления D P уравновешивается давлением Лапласа (которое возникает под искривленной поверхностью внутри пузырька):
|
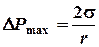
Уменьшение радиуса не может происходить беспредельно. По рис. 5 видим, что радиус пузырька не может быть меньше радиуса отверстия трубки r 0. Давление, которое компенсируется поверхностным натяжением, не превосходит D P, следовательно: 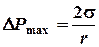 (r 0 = 0,29 мм),
(r 0 = 0,29 мм),
где: r – радиус пузырька; s – коэффициент поверхностного натяжения.
При дальнейшем вытекании воды из аспиратора пузырек прорвется. Измерив D P max, вычисляют коэффициент поверхностного натяжения:
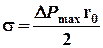 (2)
(2)
Величина D P, необходимая для прохождения пузырьков, измеряется с помощью микроманометра. Цена деления микроманометра – 2 мм водяного столба. Величина разрежения D P max подсчитывается по формуле:
D P max = rg h max,
где r – плотность воды;
g – ускорение свободного падения;
h – показания микроманометра.
Задание 2
1. Слегка приоткрыть кран К1 аспиратора (вода должна вытекать по каплям), создать постепенно увеличивающееся разрежение в пробирке В.
2. Зафиксировать показания микроманометра h max в тот момент времени, когда пузырек прорвется.
3. Вычислить s при комнатной температуре по формуле (2).
4. Поставить электроплитку под сосуд Д и включить ее в сеть.
5. Нагревать воду в пробирке В до 50°С, производя измерения по микроманометру h max через каждые 10°С (см. п. 1, 2).
6. Убрать плитку и поставить под сосуд Д емкость с холодной водой и произвести измерения по микроманометру h max через 10°С.
7. Данные измерений занести в таблицу.
8. По полученным данным вычислить s и построить график зависимости s(t).
Таблица
| Нагревание | Охлаждение | Среднее | |||||
| t | h | s | t | h | s | t | s |
Контрольные вопросы
1. Как возникает поверхностное натяжение?
2. Укажите некоторые проявления сил поверхностного натяжения.
3. Что понимают под поверхностной (потенциальной) энергией жидкости?
4. Физический смысл коэффициента поверхностного натяжения. Единицы измерения.
5. Как изменяется коэффициент поверхностного натяжения с ростом (уменьшением) температуры и почему?
6. Рассказать об определении поверхностного натяжения методом отрыва.
7. Опыт Плато.
8. Каково значение коэффициента поверхностного натяжения при критической температуре и почему?
9. Изменится ли коэффициент поверхностного натяжения воды, если добавить в воду спирт?
10. Давление Лапласа. Вывести формулу.
11. Смачивание, не смачивание. Капиллярные явления. Краевой угол. Примеры капиллярных явлений.
12. Объяснить опыт с мыльными пузырями, показывающий зависимость давления Лапласа от радиуса.
13. Почему в мыльной пене пузыри соединяются под углом 120°?
14. Почему при горячем мыльном растворе пузыри быстрее лопаются?
Литература
1. Кикоин А.К., Кикоин И.К. Молекулярная физика. – Любое издание.
2. Гершензон Е.М., Малов И.Н. Курс общей физики. Молекулярная физика. – Любое издание.
Лабораторная работа № 5
ИЗУЧЕНИЕ УСТРОЙСТВА И ПРИНЦИПА РАБОТЫ
ТЕПЛОВОЙ МАШИНЫ НА МОДЕЛИ
Цель работы: изучение устройства и принципа работы тепловой машины на модели и определение коэффициента полезного действия.
Введение
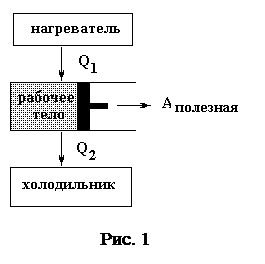 Тепловая машина – машина, которая преобразует внутреннюю энергию сгорания топлива в механическую работу. Любая тепловая машина имеет нагреватель, холодильник, рабочее тело. Рабочим телом обычно является газ, т. к. он значительно сильнее расширяется при нагревании, чем жидкие или твердые тела. В результате теплопередачи (см. рис. 1) рабочее тело получает от нагревателя количество теплоты Q 1. При этом происходит расширение рабочего тела и совершение положительной работы над внешними телами. Все тепловые машины работают циклически. Для цикличности процесса необходимо сжатие рабочего тела и неизбежная теплопередача некоторого количества теплоты Q 2 от рабочего тела к холодильнику.
Тепловая машина – машина, которая преобразует внутреннюю энергию сгорания топлива в механическую работу. Любая тепловая машина имеет нагреватель, холодильник, рабочее тело. Рабочим телом обычно является газ, т. к. он значительно сильнее расширяется при нагревании, чем жидкие или твердые тела. В результате теплопередачи (см. рис. 1) рабочее тело получает от нагревателя количество теплоты Q 1. При этом происходит расширение рабочего тела и совершение положительной работы над внешними телами. Все тепловые машины работают циклически. Для цикличности процесса необходимо сжатие рабочего тела и неизбежная теплопередача некоторого количества теплоты Q 2 от рабочего тела к холодильнику.
Q 1 = Q 2+ A пол+ Q потер ь (1)
Описание экспериментальной установки и эксперимента
В данной модели тепловой машины (см. рис. 2) нагревателем является теплая вода, холодильником – окружающий воздух, рабочим телом – воздух в колбе и под поршнем. Поршень изготовлен из ведерка Архимеда. Для измерения температуры применяется термометр, который выдается преподавателем. Для измерения давления имеется жидкостной манометр с подкрашенной водой. Давление находится по формуле: P = ρ gh,
где ρ – плотность воды (находится по справочнику);
g – ускорение свободного падения;
h – разность уровней в манометре.
Машина совершает работу по поднятию груза (гирьки). Для изучения циклической работы тепловой машины проведем цикл, состоящий из двух изохор и двух изобар (рис. 3). В исходном состоянии газ имеет атмосферное давление и минимальный объем (поршень внизу). Ставим груз массой m = 20 грамм на поршень. Нагреваем на плитке сосуд с водой до температуры t = 50 °C, устанавливаем его на подъемный столик и погружаем колбу в воду. Давление газа начинает расти, что видно по манометру. Но объем некоторое время не меняется, т. к. сила давления недостаточна, чтобы поднять поршень с грузом. Происходит изохорический процесс (участок 1–2 на диаграмме). Как только сила давления будет достаточна, груз начнет подниматься. Давление при этом остается неизменным. Происходит изобарическое расширение (участок 2–3). Это давление необходимо измерить, зафиксировав показания манометра. Когда газ примет температуру воды, груз не будет подниматься (точка 3). В этот момент измеряем температуру воды. Снимаем поднятый груз и медленно убираем нагреватель. Давление газа начинает уменьшаться (см. на манометр). Поршень некоторое время не движется, т. к. сила давления газа значительно больше веса поршня. Происходит изохорический процесс (участок 3–4). Как только давление достаточно упадет, поршень пойдет вниз при постоянном давлении (участок 4–1). Цикл замкнулся. В результате цикла совершена полезная работа по поднятию груза из нижнего положения в верхнее.
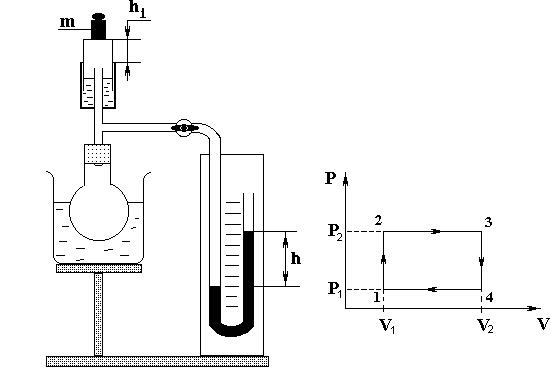
Рис. 2 Рис. 3
Расчет к.п.д. данной модели
Полезная работа равна увеличению потенциальной энергии поднятого груза (A пол = m g h 1). Количество теплоты, взятое от нагревателя, находится по формуле:
Q 1 = C в m в (t кон – t нач ) (2)
где С в – удельная теплоемкость воздуха (находится по справочнику);
mв – масса воздуха в колбе и под поршнем;
t кон, t нач – начальная и конечная температуры.
Масса воздуха находится по формуле: m в = ρ в V в ,
где ρ в – плотность воздуха (находится по справочнику);
V в – объем воздуха определяется экспериментально.
Начальная температура равна комнатной, а конечная определяется измерением температуры воды в тот момент времени, когда поршень перестанет перемещаться. По полученным данным вычисляем к.п.д. (η) по формуле:
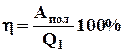 (3)
(3)
Выполнение работы
1. Провести эксперимент.
2. Вычислить полезную работу (A пол = m g h 1).
3. Вычислить к.п.д. (η) данной модели.
4. Построить диаграмму P(V) цикла.
5. Вычислить полную работу цикла (A = P D V) и сравнить ее с полезной работой.
Контрольные вопросы
1. Какие процессы называются циклическими (круговыми)?
2. Цикл Карно.
3. Получить формулу для к.п.д. идеальной тепловой машины.
4. Холодильные установки. Устройство холодильника.
5. Первый закон термодинамики.
6. Различные формулировки второго начала термодинамики (Томсона-Планка, Клаузиуса).
7. Понятие энтропии (закон возрастания энтропии).
8. В чем отличие эффективного к.п.д. от термодинамического?
9. При каких измерениях производится наибольшая ошибка?
10. Почему в автомобильных двигателях используется 4 цилиндра?
Литература
1. Яковлев В.Ф. Курс физики. Теплота и молекулярная физика. – Любое издание.
Лабораторная работа № 6
ОПРЕДЕЛЕНИЕ КОЭФФИЦИЕНТОВ ВЯЗКОСТИ
ЖИДКОСТИ И ГАЗА
Цель работы: экспериментальное определение коэффициентов вязкости жидкости и газа при их течении через капилляр.
Введение
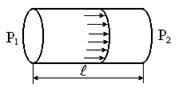
Объем жидкости или газа, протекающий через капилляр при ламинарном течении, определяется формулой Пуазейля:

 ,
,
 где η – коэффициент вязкости жидкости (газа);
где η – коэффициент вязкости жидкости (газа);
r – радиус капилляра;
D P – изменение давления в капилляре;
l – длина капилляра;
t – время течения жидкости (газа) через
капилляр.
Используя эту формулу, можно найти коэффициент вязкости жидкости или газа:
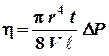 (1)
(1)
Определение коэффициента вязкости жидкости
Схема прибора, служащего для определения коэффициента вязкости, изображена на рис. 1.
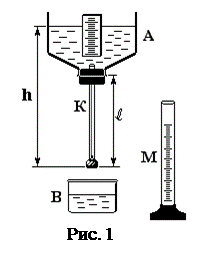 Исследуемая жидкость (вода) наливается в сосуд А. Через пробку этого сосуда проходит капилляр длиной l, радиус капилляра r, нижний конец которого закрыт резиновой пробкой.
Исследуемая жидкость (вода) наливается в сосуд А. Через пробку этого сосуда проходит капилляр длиной l, радиус капилляра r, нижний конец которого закрыт резиновой пробкой.
l (длина капилляра)= 240мм,
r (радиус капилляра)= 0,65мм.
На стенке сосуда А находится шкала, по которой измеряется высота уровня жидкости от нижнего конца капилляра.
Если открыть пробку, то в капилляре возникнет ламинарное течение воды. Объем воды, протекающей по капилляру за некоторое время, можно определить с помощью мензурки М. Величина изменения давления D Р равна в дан-
ном случае давлению столба жидкости высотой h, но т. к. высота столба
жидкости в сосуде по мере вытекания изменяется, то берется средняя
высота h ср.
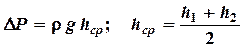 ,
,
где h 1 – высота уровня воды до вытекания;
h 2 – высота уровня воды после вытекания;
r– плотность жидкости.
Выполнение работы
1. Зафиксировать начальную высоту уровня воды h 1.
2. Открыть капилляр, т. е. вытащить пробку, одновременно включить секундомер.
3. Через определенное время (60–100 сек.) закрыть капилляр, и одновременно остановить секундомер.
4. Измерить конечную высоту уровня воды h 2.
5. Измерить объем вытекшей воды с помощью мензурки.
6. Вычислить коэффициент вязкость жидкости h по формуле (1).
7. Опыт проделать не менее 3 раз. Результаты занести в таблицу 1.
Таблица 1
| № | h 1 | h 2 | h ср | D Р | t | V | h | hср |
h = hср +∆hср
Определение коэффициента вязкости газа
Установка для определения коэффициента вязкости газа (рис. 2), состоит из сосуда С, дифференциального керосинового манометра ДМ, капилляра К, осушителя В.
Сосуд С имеет краны К1 и К2. Через кран К2 сосуд С соединяется с капилляром К длиной l, радиус капилляра r:
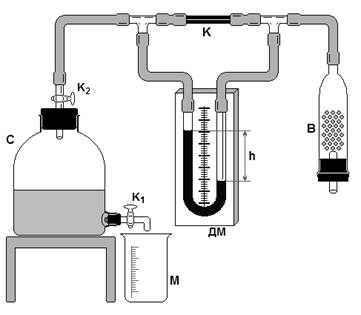 r (капилляра) = 0,19 мм;
r (капилляра) = 0,19 мм;
l (капилляра) = 10 см;
r (керосина) = 0,8 г/см3.
Через кран К1 вода может выливаться из сосуда С.
|
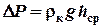 ,
,
где rк – плотность керосина.
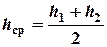 ,
,
где h 1 – начальная разность уровней жидкости;
h 2 – конечная разность уровней жидкости.
Выполнение работы
1. Открыть кран К1 и К2.
2. Как только уровень воды в мензурке будет равен 50 мл, зафиксировать начальную разность уровня h 1 в манометре, включить секундомер.
3. Секундомер остановить при вытекании следующих 50 мл воды и зафиксировать конечную разность h 2.
4. По формуле (1) найти коэффициент вязкости воздуха h.
5. Опыт проделать не менее 3-х раз. Найти среднее значение hср .
6. Результаты занести в таблицу 2.
Таблица 2
| № | h 1 | h 2 | h ср | D Р | t | V | h | hср |
| 1. | ||||||||
| 2. | ||||||||
| 3. |
h = h ср±∆ h ср
Контрольные вопросы
1. Что такое вязкость?
2. Каков физический смысл коэффициента вязкости?
3. Каков механизм вязкости в газах?
4. Записать уравнение, выражающее внутреннее трение. Что называют градиентом скорости?
5. Какая связь между коэффициентом динамической и кинематической вязкости?
6. Вывести формулу для коэффициента вязкости газа 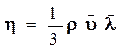 .
.
7. Как коэффициент вязкости газа зависит от температуры и давления?
8. Из экспериментальных данных по вязкости газа вычислить средний эффективный диаметр молекул воздуха.
9. Можно ли в этой работе использовать не капилляр, а трубку, имеющую больший диаметр?
Литература
1. Фриш С.Э., Тиморева А.К. Курс общей физики. – Т. 1. – Любое издание.
2. Кикоин А.К., Кикоин И.К. Молекулярная физика. – Любое издание.
Лабораторная работа № 7
ОПРЕДЕЛЕНИЕ УДЕЛЬНОЙ ТЕПЛОТЫ
ПАРООБРАЗОВАНИЯ
Цель работы: изучение процессов парообразования и конденсации.
Введение
Если нагреть воду до температуры кипения и продолжать нагревать дальше, то мы не заметим повышения температуры. Сообщаемая воде теплота идет на парообразование (превращение воды в пар), т. е. на работу преодоления молекулярных сил сцепления и на работу расширения.
Испарение жидкости может происходить при любой температуре.
Удельной теплотой парообразования называется количество теплоты, необходимое для превращения в пар 1 кг жидкости при постоянной температуре.

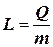
Молярной теплотой парообразования называется количество теплоты, необходимое для превращения в пар 1 моля жидкости при постоянной температуре.
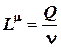
Для испарения массы жидкости m требуется количество теплоты
Q = mL.
При конденсации пара выделяется та же теплота, которая была затрачена на парообразование. Этим обстоятельством пользуются для измерения L, т. к. теплоту конденсации измерять легче.
Определение удельной теплоты парообразования L
методом смешивания
В калориметр с водой пропускают пар (рис. 1). В результате вода в калориметре и сам калориметр нагреваются. Массу конденсата можно найти, взвешивая калориметр до и после нагревания.
В адиабатической системе, какой является калориметр, выполняется уравнение теплового баланса:

Составьте это уравнение формулой, введя следующие обозначения:
t 1 – температура воды до нагревания;
t 2 – установившаяся температура;
t k – температура конденсата;
m k – масса конденсата;
m 1 – масса воды в калориметре до нагревания;
m 2 – масса калориметра;
с 1 – удельная теплоемкость воды;
с 2 – удельная теплоемкость алюминия;
L – удельная теплота парообразования.
Описание экспериментальной установки
Кипятильник А образует пар, температура которого определяется по формуле зависимости температуры кипения от давления:
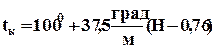
где Н – атмосферное давление по барометру в м рт.ст. (подставляем в метрах).
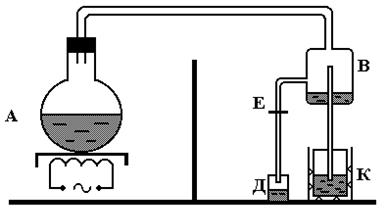
Рис. 1
Пар уносит с собой из кипятильника мельчайшие капельки воды при температуре кипения. Если эти капельки попадут в калориметр, то будут засчитаны в массе пара, но теплоту парообразования в калориметре они отдавать не будут. Это вносит ошибку. Пар должен попадать в калориметр без капелек воды. Такой пар называется сухим. Пар осушается в сухопарнике В. В отверстие С проходит только сухой пар, капельки воды оседают в сосуде Д. Вода, накопившаяся в сухопарнике, удаляется через кран Е, чтобы она не заливалась в отверстие С.
Выполнение работы
1. Взвесьте, с точностью до 50 мг, пустую внутреннюю банку калориметра.
2. Налейте воду комнатной температуры во внутреннюю банку калориметра на 1/2 ее объема.
3. Взвесьте банку с водой. Измерьте начальную температуру воды t1.
4. Вставьте внутреннюю банку калориметра во внешнюю. Включите электроплитку. Удалите конденсат из сухопарника.
5. Пропускайте пар через воду до повышения ее температуры от t 1 до t (температура должна повыситься на 25-30 °С от первоначальной).
6. Не вынимая термометра, уберите калориметр из-под паропровода, перемешайте воду и измерьте конечную температуру t.
7. Взвесьте внутреннюю банку калориметра для определения массы конденсата m k.
8. Данные запишите в таблицу.
| ОБОЗНАЧЕНИЯ | ОПЫТЫ | ||
| 1 | 2 | ||
| Масса калориметра | m 2 | ||
| Масса калориметра с водой | m 1+ m 2 | ||
| Начальная температура воды | t 1 | ||
| Конечная температура воды | t | ||
| Масса конденсата | m k | ||
| Масса калориметра и воды после пропускания пара | m 1+ m 2+ m k | ||
| Атмосферное давление | H | ||
| Температура пара | t k |
Вычислить L из уравнения теплового баланса. Записать результаты опыта:
L 1 =
L 2=
L ср =
Определение L по зависимости давления насыщенных паров
от температуры
 Насыщенный пар – пар, который находится в динамическом равновесии с жидкостью (количество молекул, вылетевших с поверхности жидкости, равно количеству молекул, возвратившихся обратно в жидкость).
Насыщенный пар – пар, который находится в динамическом равновесии с жидкостью (количество молекул, вылетевших с поверхности жидкости, равно количеству молекул, возвратившихся обратно в жидкость).
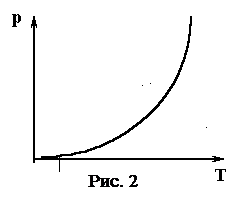
Из теории известно, что упругость насыщенных паров весьма быстро возрастает с повышением температуры по экспоненциальному закону (рис. 2).
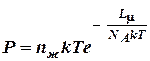 ,
,
где n ж – концентрация молекул жидкости;
k – постоянная Больцмана;
L μ – молярная скрытая теплота испарения;
N A – число Авогадро.
Для практического использования уравнение (1) удобнее переписать в виде:
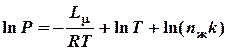
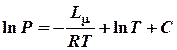 , (2)
, (2)
где 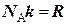 ;
;
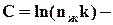 константа, характерная для данной жидкости.
константа, характерная для данной жидкости.
Т.к. второй член уравнения (2) есть медленно изменяющаяся функция температуры, то в первом приближении ее можно считать постоянной величиной и включить в константу. Тогда уравнение (2) перепишется в виде:
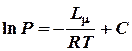 (3)
(3)
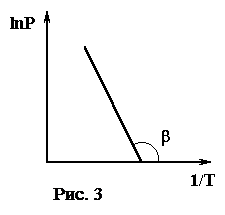 При графическом изображении этой функции удобно по оси абсцисс откладывать 1 /Т. Тогда функция (3) изобразится в виде прямой (рис. 3). Зависимость упругости насыщенного пара от температуры исследована для многих веществ.
При графическом изображении этой функции удобно по оси абсцисс откладывать 1 /Т. Тогда функция (3) изобразится в виде прямой (рис. 3). Зависимость упругости насыщенного пара от температуры исследована для многих веществ.
Тангенс угла наклона прямой равен:
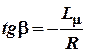
Значит из измерений температурной зависимости упругости насыщенного пара данного вещества можно, пользуясь графиком, определить значение теплоты испарения этого вещества.
L μ = - Rtg b, тогда 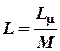 ,
,
где М – молярная масса воды.
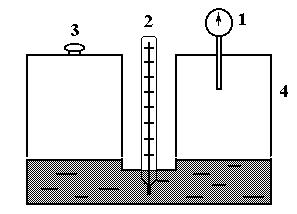 Описание экспериментальной установки
Описание экспериментальной установки
Схема установки дана на рис. 4. Она позволяет снять зависимость давления насыщенных паров от температуры.
1. Манометр.
2. Термометр.
3. Пробка.
4. Котел.
Рис. 4
Выполнение работы
1. Нагреть воду до кипения на плитке при открытом сосуде.
2. Прокипятить воду в течение нескольких минут, плотно закрыть сосуд пробкой.
3. Снять зависимость давления насыщенных паров от температуры при нагревании и охлаждении (при закрытом сосуде).
4. Результаты занести в таблицы 1, 2.
Таблица 1
| P, (Па) 105 | 0,1 | 0,2 | 0,3 | 0,4 | 0,5 | 0,6 | 0,7 |
| Т, К |
Таблица 2
| ln P | |||||||
| 1/T, (К -1) 10-3 |
5. Построить график зависимости Р(Т).
6. На основании полученных данных построить график зависимости lnP насыщенных паров от 1 /Т.
7. Вычислить, пользуясь графиком L μ и L.
Контрольные вопросы
1. На что тратится энергия, передаваемая жидкости при нагревании?
2. На что тратится кинетическая энергия теплового движения молекул жидкости при испарении?
3. Испарение и конденсация.
4. Упругость насыщенного пара. Как изменяется упругость насыщенного пара с повышением температуры?
5. Вывести формулу зависимости давления насыщенных паров от температуры.
6. Что называется скрытой теплотой испарения (парообразования)? Един
 2015-10-22
2015-10-22 930
930








