Чтобы от квантовых распределений перейти к классическим функциям, надо перейти от суммирования  к интегрированию
к интегрированию  . Для этого выделим в фазовом пространстве (пространстве координат-импульсов всех частиц) элементарную ячейку (а в классической механике можно сделать объём сколь угодно малым). Объём этой ячейки, учитывая соотношение неопределённостей Гейзенберга,
. Для этого выделим в фазовом пространстве (пространстве координат-импульсов всех частиц) элементарную ячейку (а в классической механике можно сделать объём сколь угодно малым). Объём этой ячейки, учитывая соотношение неопределённостей Гейзенберга,  (Δ x Δ px ≤ h 3, V =Δ x Δ px). h 3 N – объём всех частиц.
(Δ x Δ px ≤ h 3, V =Δ x Δ px). h 3 N – объём всех частиц.
Для перехода от  к
к  нужно вместо интегрирования по всему фазовому пространству провести интегрирование лишь по тем областям, которые соответствуют различным физическим состояниям. Для N частиц таких состояний будет в N! раз меньше (как следствие тождественности одинаковых частиц), т.е. интеграл будет выглядеть так:
нужно вместо интегрирования по всему фазовому пространству провести интегрирование лишь по тем областям, которые соответствуют различным физическим состояниям. Для N частиц таких состояний будет в N! раз меньше (как следствие тождественности одинаковых частиц), т.е. интеграл будет выглядеть так:
 .
.
Парадокс Гиббса
 Представим себе мысленный эксперимент: пусть имеется сосуд, который наполнен газом и разделён на два одинаковых отсека перегородкой (рис.2.9). Свойства газа в отсеках абсолютно одинаковы. Если убрать перегородку, то из физических соображений ничего не должно произойти, т.е. энтропия системы должна остаться неизменной. Посчитаем её. Энтропия до убирания перегородки:
Представим себе мысленный эксперимент: пусть имеется сосуд, который наполнен газом и разделён на два одинаковых отсека перегородкой (рис.2.9). Свойства газа в отсеках абсолютно одинаковы. Если убрать перегородку, то из физических соображений ничего не должно произойти, т.е. энтропия системы должна остаться неизменной. Посчитаем её. Энтропия до убирания перегородки:
 . (2.46)
. (2.46)
Уберём перегородку: 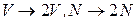 . Изменяется и значение энтропии:
. Изменяется и значение энтропии:
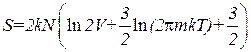 , (2.47)
, (2.47)
 , (2.48)
, (2.48)
т.е. энтропия возрастает, хотя не должна. Ответ на это противоречие заключается в том, что энтропия определена с точностью до константы ( ). Гиббс предложил следующее выражение для S 0:
). Гиббс предложил следующее выражение для S 0:
 . (2.49)
. (2.49)
Но, если использовать квантовое распределение Гиббса – парадокса можно избежать. Здесь выражение для S 0 выглядит по-другому:
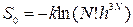 , (2.50)
, (2.50)
 , т.е. если
, т.е. если  , то формула совпадает с (2.49).
, то формула совпадает с (2.49).
2.10. Третье начало термодинамики с точки зрения статистической
физики
Одним из основных положений термодинамики является утверждение о том, что энтропия всякого тела стремится к нулю при стремлении к нулю температуры:
 . (2.51)
. (2.51)
Это утверждение представляет собой содержание так называемой теоремы Нернста. Иногда утверждение (2.51) называют третьим началом термодинамики.
С точки зрения статистической физики это утверждение может быть интерпретировано следующим образом. Рассмотрим систему, находящуюся в равновесии при температуре, стремящейся к нулю кельвинов. При этом система находится в состоянии с наименьшей энергией (основном состоянии). Тогда в каноническом распределении Гиббса наибольшим будет слагаемое, отвечающее наименьшей энергии, а остальные будут стремиться к нулю (в силу условия нормировки). Как было показано ранее, такое распределение соответствует энтропии системы и равно нулю. Таким образом, третье начало термодинамики с точки зрения статистической физики можно сформулировать так: при нуле кельвинов система находится, в основном, в полностью определенном состоянии, что соответствует нулевой энтропии (как мере неопределенности).
Флуктуации
Пусть ƒ — любая физическая величина, испытывающая флуктуации. Флуктуацией величины ƒ называется отклонение  мгновенного значения этой величины от ее среднего значения. Очевидно, что <Δƒ> = 0. Поэтому обычно пользуются средним квадратом флуктуации, т.е. величиной (<Δƒ>)2. Квадратный корень из этой величины
мгновенного значения этой величины от ее среднего значения. Очевидно, что <Δƒ> = 0. Поэтому обычно пользуются средним квадратом флуктуации, т.е. величиной (<Δƒ>)2. Квадратный корень из этой величины  называется — среднеквадратичной относительной флуктуацией.
называется — среднеквадратичной относительной флуктуацией.
Усредняя выражение  , получим
, получим
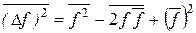 .
.
Но ƒ – величина постоянная, а потому 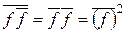 . Следовательно,
. Следовательно,
 . (2.52)
. (2.52)
Усредним теперь произведение двух флуктуирующих величин:
fg = (< f> + Δƒ) (< g> + Δ g)=  ,
,
Так как f и g — величины постоянные, а (<Δƒ>)= <Δ g >= 0, то
 . (2.53)
. (2.53)
Формула (2.52) содержится здесь как частный случай, который получается при g = f.
Величины f и g называются статистически независимыми, если
<Δ f Δ g >= 0.
Для таких величин:
<fg>=<f><g>. (2.54)
Рассмотрим теперь любую физическую систему, состоящую из N независимых одинаковых частей. Примером такой системы может служить идеальный газ, а составных частей — отдельные молекулы. Пусть ft — произвольная аддитивная величина, характеризующая i -ю подсистему, например, в приведенном примере - кинетическая энергия r '-й молекулы. Тогда в силу предполагаемой аддитивности соответствующая величина для всей системы будет F = Σ ƒi. Выразим средний квадрат флуктуации величины F через аналогичный квадрат для величины ƒi. Очевидно, < F> = Σ <ƒ>i = N<f>, где индекс i опущен, так как предполагается, что все составные части системы тождественны. Далее,
 .
.
А так как эти части независимы, то <ƒi ƒj >= <ƒi >< ƒj >=(<ƒ>)2. Следовательно,  .
.
Подставляя эти значения в формулу (2.52), получим
 . (2.55)
. (2.55)
Отсюда на основании (2.52)
 . (2.56)
. (2.56)
С увеличением N относительная флуктуация величины F убывает обратно пропорционально  При больших N относительные флуктуации ничтожны. Этот вывод качественно верен и для неаддитивных величин. С ним связана достоверность термодинамических результатов для больших макроскопических систем.
При больших N относительные флуктуации ничтожны. Этот вывод качественно верен и для неаддитивных величин. С ним связана достоверность термодинамических результатов для больших макроскопических систем.
В соответствии со сказанным видим, что в объемах с большим средним числом частиц N относительные флуктуации малы и трудно доступны наблюдению. Наоборот, при малых N относительные флуктуации велики. Более общий метод вычисления флуктуации плотности, применимый также к жидкостям и твердым телам, основан на теореме о равномерном распределении кинетической энергии по степеням свободы. Рассмотрим малую часть жидкости или газа, окруженную такой же жидкой или газообразной средой, температура Т которой поддерживается постоянной (термостатом). С целью упрощения и наглядности вычислений предположим, что малая часть жидкости или газа заключена в цилиндр с поршнем. Стенки цилиндра идеально проводят тепло, а поршень может ходить в нем без трения. Тогда наличие стенок цилиндра и поршня не будет препятствовать обмену энергией и выравниванию давлений между веществом в цилиндре и термостатом. Тепловое движение молекул вещества вызовет броуновское движение поршня. К этому движению поршня мы и применим теорему о равномерном распределении кинетической энергии по степеням свободы. Поршень можно рассматривать как гармонический осциллятор, совершающий беспорядочные тепловые колебания. Среднее значение его потенциальной энергии при смещении на х из положения равновесия х = 0 равно (1/2)к х2 = ( 1/2 )кТ, где к — жесткость, соответствующая такому смещению. Если S — площадь поршня, a AV — изменение объема системы, то D V = Sx. Таким образом, < ( Δ V)2 > = < S2x2>= S2kT/K. Сила, возвращающая поршень в положение равновесия, будет  , где Р — давление газа или жидкости. Поэтому к = — SdP/dх =S2dP/dV. В результате получим
, где Р — давление газа или жидкости. Поэтому к = — SdP/dх =S2dP/dV. В результате получим
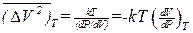 . (2.57)
. (2.57)
Знак Т указывает, что в выводе предполагалось постоянство температуры окружающей среды (термостата). Если бы вещество внутри объема V было адиабатически изолировано, то индекс Т следовало бы заменить на S (постоянство энтропии), т.е.
<(Δ V 2 )>s = - kT(dV/dP)s. (2.58)
Формулы (2.57) и (2.58) выражают флуктуации объема одной и той же массы вещества, находящейся в термодинамическом равновесии с окружающей средой.
Для идеального газа при постоянной температуре PV = const, так что (dV/dP) т = -V/P. А так как PV - NкТ, где N - число молекул в объеме V, то из формулы (2.57) получаем (Δ V 2 )=V2/N.
Перейдем теперь к вычислению флуктуации энергии. С целью лучшего уяснения метода начнем с вычисления флуктуации кинетической энергии e молекулы одноатомного идеального газа в отсутствие силовых полей. Согласно максвелловскому закону распределения скоростей
 , (2.59)
, (2.59)
где α = 1/кT, dГ - элементы объема пространства скоростей, а Z определяется условием нормировки:
 . (2.60)
. (2.60)
Дифференцируя это соотношение по параметру α, получим

и формула (2.59) перейдет в
 . (2.61)
. (2.61)
Отсюда
 .
.
Аналогично
 . (2.62)
. (2.62)
 2015-10-22
2015-10-22 1342
1342
