Выражением Периодического закона является периодическая система элементов.
Физический смысл химической периодичности
Периодические изменения свойств химических элементов обусловлены правильным повторением электронной конфигурации внешнего энергетического уровня (валентных электронов) их атомов с увеличением заряда ядра.
Графическим изображением периодического закона является периодическая таблица. Она содержит 7 периодов и 8 групп.
Строение атома
Атом — это наименьшая химически неделимая частица, входящая в состав молекул простых и сложных веществ.
В свою очередь, атом состоит из более мелких частиц – протонов, нейтронов и электронов.
Английский физик Дж. Дж. Томсон предположил, что атом представляет собой некую субстанцию, в которой равномерно распределены протоны, нейтроны и электроны. Число протонов равно числу электронов, поэтому атом в целом электронейтрален. Эту модель строения атома Томсона образно называют «сливовый пудинг», булочка с изюмом (где «изюминки» – это электроны), или «арбуз» с «семечками» – электронами.

| Частица | Обозначение | Заряд | Относительная атомная масса |
| Протон | p+ | + | |
| Нейтрон | n0 | ||
| Электрон | e- | – | 1/1840 |
Однако от этой модели отказались, т. к. были получены экспериментальные данные, противоречащие ей.
В 1910 году английский физик Эрнст Резерфорд со своими учениками Гейгером и Марсденом провели эксперимент, который дал поразительные результаты, необъяснимые с точки зрения модели Томсона. Эрнст Резерфорд доказал на опыте, что в центре атома имеется положительно заряженное ядро, в котором сконцентрирована основная масса атома, поскольку ядро содержит протоны и нейтроны; вокруг ядра, подобно планетам вокруг Солнца, на огромной скорости вращаются электроны, так называемая планетарная модель строения атома Резерфорда. Атом в целом электронейтрален, а электроны удерживаются в атоме за счет сил электростатического притяжения (кулоновских сил). Эта модель имела много противоречий и главное, не объясняла, почему электроны не падают на ядро, а также возможность поглощения и излучения им энергии.



Характеристика атома
1. Атом состоит из ядра и электронной оболочки. Ядро состоит из протонов и нейтронов, а электронная оболочка – из электронов. Радиус ядра примерно в 100000 раз меньше радиуса атома.
2. Так как масса электрона незначительна по сравнению с массами протона и нейтрона, то ею можно пренебречь, то есть масса атома (называется массовым числом) сосредоточена в ядре:
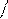
 m ат= mp + mn + me
m ат= mp + mn + me
3. Ядро заряжено положительно за счёт протонов.
4. Электроны заряжено отрицательно, вращаются вокруг ядра и вокруг своей оси по «часовой стрелки» или против «часовой стрелки». Движение электрона вокруг своей оси называется «спин».
5. Число протонов равно числу электронов, поэтому атом будет электронейтрален. Атом из периодической таблицы – всегда электронейтрален.
6. Число протонов соответствует порядковому номеру элемента в таблице ПСХЭ (Периодической системе химических элементов).
7. Число нейтронов: nn = m ат – np (масса атома минус число протонов).
 Fe 26 Железо Fe 26 Железо  55,8 55,8 |
Порядковый номер
Относительная масса
5626Fe (26р+; 30n0) 26e-
При изменении числа протонов образуется другой химический элемент.
Химический элемент – это вид атома с одинаковым числом протонов, т.е. с одинаковым зарядом ядра.
При изменении числа нейтронов элемент не изменяется, а изменяется его масса и образуется изотоп.
Изотопы – это разновидности атома данного химического элемента, различающиеся массой атома, т.е атомы с одинаковым числом протонов, но разным числом нейтронов.
Например, элемент водород имеет три изотопа: протий (11H), дейтерий (12H) и тритий (13H). Первые два существуют в природе, тритий получен искусственным путем. Подавляющее большинство химических элементов имеет разное число природных изотопов с разным процентным содержанием каждого из них.
Относительная атомная масса элемента, которая приводится в периодической системе, – это средняя величина массовых чисел природных изотопов данного элемента с учетом процентного содержания каждого из этих изотопов. Химические свойства всех изотопов одного химического элемента одинаковы. Следовательно, химические свойства элемента зависят не от атомной массы, а от заряда ядра.
При изменении числа электронов ни элемент, ни его масса не изменяется, а изменяется заряд атома и образуются ионы.
Ионы – это заряженные разновидности атомов данного химического элемента, у которых одинаковое число протонов, но разное число электронов.
 |
Задача.
 Что получим, если в цинке +1p+, -3n0, -2e-?
Что получим, если в цинке +1p+, -3n0, -2e-?
| 6530Zn0 | 30 p+ 35 n0 30 e- | +1p+ -3n0 -2e- | 31 p+ 32 n0 28 e- | 6331Ga+3 | 6931Ga0 |
Катион изотопа галлия
Бор предположил, что электроны в атоме могут устойчиво существовать только на орбитах, удаленных от ядра на строго определенные расстояния. Эти орбиты он назвал стационарными. Вне стационарных орбит электрон существовать не может. Почему это так, Бор в то время объяснить не мог. Но он показал, что такая модель позволяет объяснить многие экспериментальные факты, например, почему при химических реакциях тепло или выделяется, или поглощается – из-за перехода электрона с уровня на уровень. Данная модель строения атома получила названия «модель Бора».

Квантовая механика представила более современную модель строения атома.
В настоящее время согласно современным квантово-механическим представлениям электроны обладает свойствами частицы и волны одновременно, т. е. корпускулярно-волновым дуализмом (электрон одновременно – это и частица, и волна) и при вращении образуют различной формы электронные облака.
 2017-10-25
2017-10-25 1811
1811
