Пример 1. Какому количеству вещества соответствует 56 г азота и сколько молекул азота содержится в этом количестве?
Решение. Молярная масса атома азота (N) равна 14 г, молярная масса молекулы азота (N2) равна 28 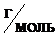 . Следовательно, 56 г соответствует двум моль.
. Следовательно, 56 г соответствует двум моль.
Моль – количество простого или сложного вещества, содержащее такое число структурных частиц: атомов, молекул, ионов или электронов, которое равно числу атомов в 12 г изотопа углерода 12 С и составляет 6,022·1023 (постоянная Авогадро, NА).
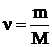 , (1)
, (1)
где ν – количество вещества;
m – масса вещества;
M – молярная масса вещества.
 = 2 моль
= 2 моль
Пример 2. Найти массу 200 л хлора при н. у.
Решение. Из закона Авогадро следует, что один моль любого газа при н. у. занимает объем 22,4 л (молярный объем). Один моль газоoбразного хлора Cl2 имеет массу 71 г (молярная масса атома хлора – 35,5 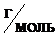 ).
).
71 г – 22,4 л
x г – 200 л
 = 633,2 г.
= 633,2 г.
Пример 3. Вычисление молекулярной массы газа по заданному объёму.
Масса 327 мл газа при 130С и давлении 1,04*105 Па равна 828 г.
Вычислить молекулярную массу газа.
Дано:

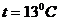
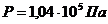

μ=?
Решение: Вычислить молекулярную массу газа можно, используя уравнение Менделеев -Клапейрона:
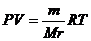
Величина газовой постояннoй определяется принятыми единицами измерения. Если давление измеряется в Па, а объём в м3, то 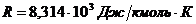 .
.
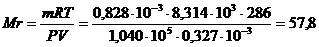
Тема№2. Химическая термодинамика и кинетика.
 2017-11-30
2017-11-30 475
475








