Значения криоскопических и эбуллиоскопических постоянных некоторых растворителей (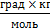 ):
):
Криоскопическая Эбуллиоскопическая
Вода 1,86 0,52
Бензол 5,1 2,57
Этиловый спирт " — 1,16
Диэтиловый эфир 1,73 2,02
Пример 1. Определение температуры кипения и замерзания раствора неэлектролита.
Определите температуру кипения и замерзания раствора, содержащего 1 г нитробензола  в 10 г бензола. Эбулиоскопическая и криоскопическая константы бензола соответственно равны 2,57 и 5,1 ̊ С. Температура кипения чистого бензола 80,2 ̊ С, температура замерзания -5,4 ̊ С(3).
в 10 г бензола. Эбулиоскопическая и криоскопическая константы бензола соответственно равны 2,57 и 5,1 ̊ С. Температура кипения чистого бензола 80,2 ̊ С, температура замерзания -5,4 ̊ С(3).
Решение. По закону Рауля следует, что
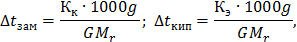
где ∆ 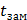 и ∆
и ∆ 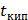 - соответственно понижение температуры замерзания и повышение температуры раствора;
- соответственно понижение температуры замерзания и повышение температуры раствора; 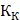 и
и 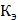 - соответственно криоскопическая и эбуллиоскопическая константы растворителя; g - масса растворенного вещества, г; G - масса растворителя, г;
- соответственно криоскопическая и эбуллиоскопическая константы растворителя; g - масса растворенного вещества, г; G - масса растворителя, г; 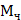 - молекулярная масса растворенного вещества;
- молекулярная масса растворенного вещества; 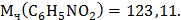
Повышение температуры кипения раствора нитробензола в бензоле:
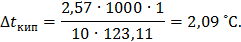
Температура кипения раствора: 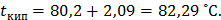 Понижение температуры замерзания раствора нитробензола в бензоле:
Понижение температуры замерзания раствора нитробензола в бензоле:
|
|
|
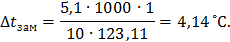
Температура замерзания раствора 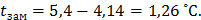
Пример 2. Вычисление молекулярной массы неэлектролита по повышению температуры кипения раствора.
Раствор камфоры массой 0,552 г в 17 г эфира кипит при температуре на 0,461̊ выше, чем чистый эфир. Эбуллиоскопическая константа эфира 2,16 ̊ С. Определите молекулярную массу камфоры.
Р е ш е н и е. Молекулярную массу камфоры определяем, пользуясь соотношением
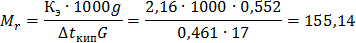
Молекулярная масса камфоры равна 155,14.
Пример 5. Вычисление криоскопической константы растворителя.
Вычислите криоскопическую константу воды, если водный раствор этилового спирта (=11,3 %) замерзает при -5 ̊ С.
Решение. Молекулярная масса этилового спирта равна 46,07. Из соотношения, приведенного в примере 1, получаем
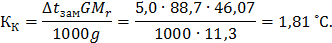
Криоскопическая константа воды 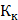 = 1,81 ̊ С.
= 1,81 ̊ С.
 2017-11-30
2017-11-30 1979
1979
