В основу даного методу покладене утворення осаду за умови, що існує зручний спосіб визначення моменту, коли додана стехіометрична кількість титранту. Класичні методи з візуальною індикацією ґрунтуються на утворенні забарвленого осаду, забарвленні розчину або зміні кольору продукту реакції осадження в ході використання адсорбційних індикаторів, таких як еозин або флуоресцин. У реакціях осадження рівновага встановлюється не завжди швидко. Розроблена велика кількість титриметричних методів, заснованих на осадженні. Найбільш важливими з них є методи титрування галогенідів аргентумом(I) та сульфатів барієм(II). У процесі визначення галогенідів, наприклад хлоридів, за методом Мору (даний метод ми розглянемо пізніше) можна застосовувати індикацію, що ґрунтується на утворенні забарвленого осаду аргентум(I) хромату. У процесі визначення аргентуму(I) за Фольгардом розчин, у якому наявні дані йони, титрують розчином роданід-іонів, а кінцеву точку титрування визначають за утворенням розчинного роданідного комплексу Fe(III), забарвленого в інтенсивний червоний колір:
Ag+ + SCN- ↔ AgSCN
Fe3+ + 3SCN- ↔ Fe(SCN)3
Утворення роданіду заліза відбувається в момент, коли весь аргентум(I) від- титрований.
Лабораторна робота 15
Визначення вмісту хлоридів у природних водах
за методом Мору
Найважливіший показник якості води – вміст у ній хлоридів. У воді, що використовується для водопостачання, вміст хлоридів не повинен перевищувати 300 мг/дм3.
Визначення хлоридів можливе за допомогою реакції
Ag+ + Cl- → AgCl
Досліджувану воду титрують розчином аргентуму(I) нітрату в нейтральному або слабколужному середовищі за наявності калію хромату(VI). Після осадження Cl--іонів надлишок іонів утворює оранжево-червоний осад Ag2CrО4.
Важливо правильно підібрати концентрацію індикатора. У разі додавання великої кількості хромату кінцева точка титрування передує точці еквівалентності. Якщо хромат введений недостатньо, то кінцеву точку фіксують пізніше.
У методі Мору важливу роль відіграє кислотність розчину. У кислих розчинах частина індикатора наявна у вигляді НCrO4-, а не у вигляді CrО42-, таким чином, для утворення осаду Ag2CrО4потрібно більше індикатора. Ідеальне значення рН для титрування – приблизно 8. Воно досягається додаванням до розчину твердого кальцію(II) карбонату. У більш лужних розчинах можливе осадження аргентуму(I) карбонату або аргентуму(I) гідроксиду.
Реактиви, обладнання: K2CrO4, w = 5%, NaCl, T = 0,823900 мг/см3; AgNO3, T (AgNO3/Cl-) = 0,500000 мг/см3, w = 10%; бюретка ємністю 25 см3, колба для титрування ємністю 250 см3, піпетка ємністю 10–25 см3.
Хід роботи
Приблизна оцінка кількісного вмісту хлоридів
У пробірку помістимо 5 см3 досліджуваної води та додамо 3–5 крапель аргентуму(I) нітрату (w = 10%). Приблизний вміст хлоридів визначимо за осадом або помутнінням із використанням даних табл. 3.
Таблиця 3
Визначення концентрації хлоридів
| Ефект, який спостерігають | Концентрація хлоридів, мг/дм3 |
| Опалесценція, або слабке помутніння | 1–10 |
| Сильне помутніння | 10–50 |
| Коагуляція дисперсної фази | 50–100 |
| Білий об’ємний осад | Більше 100 |
Кількісне визначення вмісту хлоридів
Залежно від вмісту хлоридів відберемо у дві колби по 100 см3 досліджуваної води із вмістом Cl- -іонів, не меншим 100 мг/дм3, або 10–20 см3 із вмістом Cl--іонів, більшим 100 мг/дм3. В останньому випадку доведемо загальний об’єм до 100 см3 дистильованою водою. У колбу додамо 1 см3 розчину K2CrО4 і відтитруємо стандартним розчином AgNO3 до появи світло-жовтогарячого відтінку. Вміст Cl--іонів (мг/дм3) розрахуємо за формулою
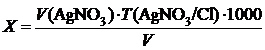 ,
,
де V (AgNO3) – об’єм стандартного розчину нітрату срібла, витрачений на титрування, см3; Т (AgNO3/Cl-) – маса Cl- - іонів, що відповідає 1 см3 розчину AgNO3; V – об’єм води, узятий для аналізу, см3.
З огляду на вищенаведене зробіть висновок про придатність води для водопостачання населенню.
Контрольні запитання та завдання
1. Укажіть індикатор і напишіть рівняння реакції, що проходить у кінцевій точці титрування роданід-іону нітратом аргентуму(I) за методом адсорбційних індикаторів.
2. Подайте схему аналізу зразка, який містить воду, хлоридну, сульфатну та хлорну кислоти. Методи повинні бути тільки титриметричними. Вміст води можна визначити за різницею.
3. Знайдіть у хімічному довіднику значення розчинності аргентуму(I) фториду. Чи можливо визначити фторид титруванням стандартним розчином аргентуму(I) нітрату
4. На підставі ДРAgCl розрахували, що в кінцевій точці титрування рAg повинен бути 5,0. Застосувавши ДРAgCl, з’ясуйте, за якої концентрації хромату починає осаджуватися Ag2CrО4, якщо рAg = 5,0. ДРAgCl = 1,3·10-12?
5. Розрахуйте рCl та рAg у ході титрування калію хлориду нітратом аргентуму(I), якщо до 20,00 см3 0,0500 М розчину КCl додали 0,0500 М розчину AgNO3 в об’ємі: а) 19,00 см3; б) 20,00 см3; 21,00 см3.
6. Яку масу наважки калію броміду слід взяти для приготування 250 см3 розчину, на титрування 20,00 см3 якого необхідно витратити 17,50 см3 0,0500 М розчину AgNO3?
 2017-12-14
2017-12-14 1250
1250








