Методи окиснення-відновлення – титриметричні методи, що ґрунтуються на застосуванні реакцій окиснення-відновлення. Основні переваги даних методів: велика точність, гарна відтворюваність, простота та експресність, широкий спектр застосування, можливість автоматизації та ін.
Методи окиснення-відновлення класифікують залежно від титранту (стандартного розчину). Наприклад, метод, заснований на окисненні перманганатом калію, називають перманганатометрією; на окисненні йодом – йодометрією; Cr (VI) – хроматометрією (дихроматометрією) і т.д.
У процесі титрування за методом окиснення-відновлення відбувається зміна окисно-відновних потенціалів реагуючих речовин. Для оборотної редокс-системи, що виражається рівнянням
а Окисн. + nē→ b Відн.,
величина окисно-відновного потенціалу Е визначається рівнянням
Е = Е 0 + (RT / n) ln([Окисн.] a / [Відн.] b),
де Е –окисно-відновний потенціал, В; Е0 –стандартний окисно-відновний потенціал, В; R – універсальна газова стала (8,31 Дж/моль·град); Т – абсолютна температура, К; n –число електронів, що беруть участь у реакції; F –число Фарадея, 96500 Кл; [Окисн.] – концентрація окисненої форми, моль/дм3; [Відн.] – концентрація відновленої форми, моль/дм3.
Якщо в реакції беруть участь H+-іони, то значення Е залежить від [Н+]:
Е = Е0 + (RT / n) ln([Окисн.] a [ Н + ] m / [Відн.] b)
Якщо ж замінити константи їх числовими значеннями та перейти від ln до lg, то в разі T = 298 K (25°C) рівняння набуде вигляду
Е = Е 0 + (0,059/ n) lg ([Окисн.] a [Н+] m / [Відн.] b).
Таким чином, потенціал окисно-відновної системи залежить від природи реагуючих речовин (Е0), температури, концентрації окисненої та відновленої форм, а також концентрації H+-іонів.
При 25 °C коефіцієнт дорівнює 0,059; при 0 °C – 0,060, тобто температура не дуже впливає на потенціал. Більш істотно вона позначається на енергії активації, швидкості та механізмі окисно-відновної реакції. Бувають випадки, коли H+-іони в реакції не беруть участі, а pН впливає на потенціал системи. Значення стандартних окисно-відновних потенціалів наведені в хімічних довідкових таблицях.
Окиснювач – речовина з великим значенням Е0. Змінюючи співвідношення концентрацій окисненої та відновленої форм, а також концентрацію H + -іонів, можна змінювати Е в широких межах, а отже, спрямовувати реакцію потрібним чином.
У деяких випадках окисно-відновного титрування точку еквівалентності фіксують за зміною забарвлення титрованого розчину, викликаною надлишком забарвленого стандартного розчину. Крім того, у методах окиснення-відновлення можуть бути використані так звані редокс-індикатори, що змінюють колір залежно від величини Е.
Перманганатометрія
Як стандартний розчин у перманганатометрії використовують розчин KMnО4, що має найбільш високу окисну активність у кислому середовищі (Е = +1,51 В).
Сутність методу. Цей метод заснований на окисній дії робочого розчину калію перманганату (KMnО4). Окиснення KMnО4 можна проводити в кислому середовищі. У ході такої реакції Mn(VII) відновлюється до Mn(II) і малинове забарвлення перманганату зникає:
MnО4- + 8H+ + 5ē ↔ Mn2+ + 4H2O
У такій реакції беруть участь 5 електронів. Отже, f екв. (KMnО4) дорівнює в даному випадку 1/5, а молярна маса еквівалента –
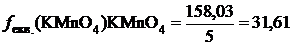 .
.
У процесі взаємодії в слабколужному або нейтральному середовищі Mn(VII) відновлюється до Mn(IV):
Mn4- + 3Н2О + 3ē → Mn(OH)2 + 4OH-
Таким чином, f екв . (KMnО4) дорівнюватиме 1/3.
Безіндикаторний метод. Роль індикатора в цьому методі завдяки його інтенсивному забарвленню відіграє сам титрант (KMnО4).
 2017-12-14
2017-12-14 959
959








