Визначення вмісту Феруму в розчинах його солей
(контрольне завдання)
Сутність методу. Визначення Феруму перманганатометричним титруванням ґрунтується на здатності KMnО4 у кислому середовищі окиснювати Fe2+ до Fe3+:
MnО4- + 5Fe2+ + 8Н+ → Mn2+ + 5Fe3+ + 4Н2О
Реактиви, обладнання: ферум(II), розчин H2SO4 (1:4), титрований розчин KMnО4 (~0,1 М (1/5 KMnО4), піпетки ємністю 10–15 см3, мірний циліндр, колба для титрування.
Хід роботи
Помістимо досліджуваний розчин солі Мору в мірну колбу ємністю 100 см3. Доведемо його об’єм до мітки дистильованою водою та перемішаємо. Одержаним розчином промиємо піпетку, перенесемо 10 см3 його в колбу для титрування. Додамо за допомогою циліндра 8–10 см3 0,2 М (1/2 H2SO4) розчину H2SO4, 80 см3 дистильованої води та відтитруємо розчином калію перманганату до появи блідо-малинового забарвлення, що не зникає під час перемішування 1–2 хв. Повторимо титрування 2–3 рази і візьмемо середнє значення. Результат аналізу визначимо в грамах заліза за формулою
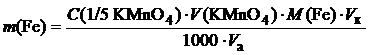 ,
,
де C (1/5 KMnО4) – молярна концентрація еквівалента KMnО4, моль/дм3; V (KMnО4) – об’єм KMnО4, витрачений на титрування розчину солі Мору, см3; Vк – об’єм мірної колби, см3; V а – об’єм аліквоти розчину солі Мору, взятої для титрування, см3; М (Fe) – молярна маса еквівалента Феруму, 56 г/моль.
Лабораторна робота 19
 2017-12-14
2017-12-14 502
502








