(контрольне завдання)
Руда, яка містить Манган, перетворюється на розчин за допомогою хлоридної кислоти. Утворений Mn2+ у нейтральному середовищі окиснюється в ході титрування розчином KMnO4.
Для нейтралізації розчину та осадження елементів, що заважають і мають вигляд гідроксидів, використовують суспензію оксиду цинку, яка додається в надлишку. Вона додається з метою:
1) нейтралізації надлишка кислоти, уведеної для розчинення;
2) нейтралізації кислоти, утвореної в результаті окиснення
3Mn2+ + 2MnO42- + 2H2O ↔ 5MnO2 + 4H+,
інакше буде відбуватися розчинення MnO2;
3) запобігання адсорбції іонів Мангану осадом мангану гідроксиду (надлишок Zn2+ унеможливлює адсорбування Mn2+).
Для кращої коагуляції осаду мангану гідроксиду титрування проводять у гарячому розчині за умови значного розведення та інтенсивного перемішування. У процесі розрахунку результатів аналізу слід звернути увагу на те, що концентрація розчину встановлюється в кислому середовищі, а визначення Mn2+ здійснюється у слабкокислому (майже в нейтральному) середовищі.
Реактиви, обладнання: 0,1000 М (1/5 KMnО4) розчин KMnО4, розчин HCl (1:1), суспензія ZnO у воді, зразки руди,мірна колба ємністю 250 см3, мірний циліндр ємністю 20 см3, бюретка ємністю 25 см3, піпетка ємністю 50 см3, колба для титрування ємністю 500 см3, електрична піч, ваги аналітичні АДВ-200.
Хід роботи
Наважку руди 0,5 г розчинимо у 20 см3 HCl (1:1) та прокип'ятимо до видалення хлору. Доллємо 100 см3 води, нагріємо до кипіння та додамо суспензію ZnO у воді, енергійно перемішуючи розчин. Якщо в руді наявний Ферум, то він при цьому співосадиться у вигляді гідроксиду на дні склянки. Під осадом гідроксиду феруму повинен залишитися надлишок ZnO (у вигляді кола діаметром 3 см). Розчин із осадом переллємо в мірну колбу ємністю 250 см3, охолодимо, розбавимо до мітки дистильованою водою, добре перемішаємо та дамо йому відстоятися.
Відберемо пробу прозорого розчину (50 см3), помістимо її у велику конічну колбу та розбавимо водою до 500 см3, нагріємо до кипіння, додамо ще невелику кількість суспензії ZnO та відтитруємо до світло-рожевого забарвлення розчину над осадом, який відстоявся.
Лабораторна робота 20
Визначення здатності води до окиснення
Здатність води окиснюватися характеризується кількістю грамів кисню, необхідного для окиснення органічних речовин, що містяться в 100 л води. Окиснення здійснюють за допомогою розчинів перманганату калію або біхромату в сульфатнокислому середовищі.
Реактиви, обладнання: 0,1000 М (1/5 KMnО4) розчин KMnО4, розчин H2SO4 (1:4), 0,1000 М (1/2 H2C2O4) розчин H2C2O4, мірний циліндр, піпетки ємністю 10–20 см3, колба для титрування ємністю 250 см3.
Хід роботи
У конічну колбу ємністю 250 см3 наллємо 100 см3 досліджуваної води, додамо 4 см3 H2SO4 (1:4) і 15 см3 0,1000 М (1/5 KMnО4) розчину KMnО4. Суміш нагріємо до кипіння та прокип'ятимо протягом 10 хв. Знебарвлення розчину свідчить про недостатню кількість уведеного окисника; у цьому випадку відберемо ще одну пробу води і повторимо визначення, увівши більшу кількість розчину KMnО4. Після кип'ятіння протягом 10 хв до розчину додамо 20 см3 0,1000 М (1/2 H2C2O4) розчину H2C2O4 і відтитруємо її надлишок 0,1000 М (1/5 KMnО4) розчином KMnО4. Результат обчислимо за формулою
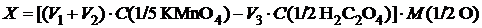 (у 100 л води),
(у 100 л води),
де X – здатність води до окиснення; V 1 – об’єм KMnО4, долитий у воду перед кип'ятінням; V 2 – об’єм KMnО4, витрачений на відтитровування надлишку H2C2O4; V 3 – об’єм доданої H2C2O4.
Дихроматометрія
У дихроматометрії робочим розчином (титрантом) для визначення відновників є розчин калію дихромату. У кислому середовищі відбувається відновлення хрому(VI) до хрому(III):
Cr2О72- + 14Н+ + 6ē → 2Cr3+ + 7Н2О; 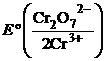 = 1,36 В.
= 1,36 В.
Таким чином, f екв.(К2Cr2О7) дорівнює 1/6 – відповідно до числа набутих електронів.
Окисно-відновний потенціал дихромат-іонів значною мірою залежить від кислотності розчину:
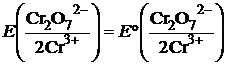 +
+ 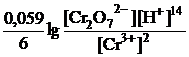 ,
,
тому титрування слід проводити в сильнокислому середовищі (хлориднокислому, сульфатнокислому). Для індикації точки еквівалентності використовують окисно-відновні індикатори – дифеніламін, дифенілбензидин, фенілантранілову кислоту).
 2017-12-14
2017-12-14 540
540








