(контрольне завдання)
Визначення розчиненого у воді кисню ґрунтується на здатності манган(II) гідрату закису окиснюватися за наявності лугу до манган(IV) гідрату:
2Mn(OH)2 + O2 → 2MnО(OH)2
Унаслідок дії на манган(IV) гідрат хлоридної кислоти утворюється вільний хлор Сl2 у кількості, еквівалентній розчиненому у воді O2:
2MnО(OH)2 + 2Cl- + 4H+ → Mn2+ + Cl2 + 3H2O
За наявності йодиду калію хлор виділяє еквівалентну кількість йоду
Cl2 + 2I - → I2 = 2Cl-,
який титрують Na2S2O3: I2 + 2S2O32- ↔ 2I- + S4O62-
Реактиви, обладнання: розчин NaOH+KI (32 г NaOH та 20 г KI у 100 см3 води), розчин MnCl2(50 г MnCl2·4H2O у 100 см3 води), ~0,1 М (1/2 Na2S2O3) розчин Na2S2O3, НClконц., піпетки з довгим носиком ємністю 1 см3, бюретка ємністю 25 см3, розчин крохмалю.
Хід роботи
Кількість розчиненого у воді кисню може зазнавати значних коливань, тому її визначення починають завжди на місці взяття проби. Послідовність дій при цьому така: досліджувану воду набирають у точно прокалібровану склянку з притертим корком ємністю від 150 до 300 см3 так, щоб у разі її закривання між корком і водою не було повітря. У процесі наповнення склянки реєструють температуру води. У випадку взяття проби з водопровідного крана на нього надівають каучукову трубку, вільний кінець якої опускають на дно склянки. Відкривши кран, дають воді протягом декількох хвилин переливатися через горло склянки, після чого її обережно закривають корком. Коли склянка в такий спосіб буде заповнена, у неї послідовно, за допомогою спеціальних піпеток із довгими носиками, що опускаються на дно склянки, уводять 1 см3 розчину NaOH + KI та 1 см3 розчину, що містить MnCl2. Після цього склянку закривають корком, струшують і залишають на деякий час. Коли на її дні з’явиться осад, у неї доливають таким же чином, як і попередні розчини, 3–5 см3 концентрованої НCl та закривають корком. Після повного розчинення осаду вміст склянки переливають у колбу, а її промивають дистильованою водою та виливають рідину в ту ж колбу, потім титрують розчином натрію тіосульфату, додавши під кінець титрування крохмальний розчин. Одержані результати обчислюють за формулою
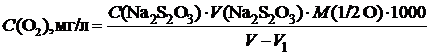 ,
,
де V – ємність склянки (см3); V 1 – об’єм улитих реактивів (см3).
Контрольні запитання та завдання
1. Як обчислюють фактор еквівалентності в окисно-відновних реакціях?
2. Чому недоцільно брати точну наважку KMnО4 у разі готування його розчину для титрування?
3. Укажіть способи визначення кінцевої точки титрування в редокс-методах.
4. Перелічіть відомі вам титранти, що мають окисні або відновні властивості, і вкажіть, що можна визначати за допомогою цих титрантів.
5. Що таке стандартний окисно-відновний потенціал?
6. Напишіть рівняння, яке описує залежність окисно-відновного потенціалу від концентрації.
7. Перелічіть фактори, що впливають на величину окисно-відновного потенціалу.
8. Розчином ванадію(III) із концентрацією 0,1000 М титрують 0,1000 М розчин K2Cr2O7 при рН 1,0. Розрахуйте потенціал, за якого ступінь відтитровування розчину дорівнює 1,001.
9. Наведіть рівняння для розрахунку інтервалу потенціалу переходу забарвлення окисно-відновного індикатора.
10. Чому біхроматометричне визначення феруму(II) слід проводити за наявності фосфорної кислоти? Який індикатор при цьому використовують?
 2017-12-14
2017-12-14 490
490








