Визначення загальної твердості води комплексонометричним методом
Загальна твердість води обумовлюється вмістом солей Кальцію і Магнію, вона виражається вмістом мілімолів еквівалентів (ммоль-екв) іонів Ca2+ і Mg2+ у 1000 см3 води. У деяких країнах твердість виражають у градусах твердості. 1 ммоль-екв твердості відповідає 2,8º за німецькою шкалою; 3,5º – за англійською та 5,0º– за французькою. Загальна твердість м'якої води – 2 ммоль/дм3. Загальна твердість води рік та озер у тайзі та тундрі становить 0,1–0,2 ммоль/ дм3; морів, океанів, підземних водоймищ – 80–100 ммоль/ дм3.
Комплексонометричний метод визначення твердості води ґрунтується на титруванні проби води розчином трилону Б за наявності метал-індикатора хромогену чорного:
Ca2+ + Ind2- ↔ CaInd
CaInd + Na2[H2Y] ↔ Na2[Ca] + Ind2- + 2H+
ВизначеннюCa2+і Mg2+ “заважають” Cu2+, Zn2+, Mn2+, HCO3-, CO32-.
Реактиви, обладнання: 0,0500 М (1/2 трилон Б) розчин трилону Б, амонійна буферна суміш (рН=10), індикатор хромоген чорний, піпетки ємністю 5–20 см3, бюретка ємністю 25 см3, мірні циліндри.
Хід роботи
У три колби циліндром відберемо необхідний об’єм води (50–100 см3). У разі дослідження дуже твердої води її пробу попередньо розводять та відбирають необхідний об’єм (5 см3, 10 см3, 20 см3) піпеткою. Доведемо загальний об’єм у колбі до 100 см3 дистильованою водою, додамо 10 см3 буферної суміші, 3–5 крапель індикатору й відтитруємо, постійно перемішуючи, розчином трилону Б. Наприкінці реакції здійснимо повільне титрування – до переходу забарвлення в синє, зафіксуємо об’єм розчину трилону Б, за яким розрахуємо загальну твердість води:
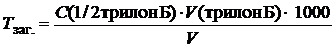 ,
,
де C (1/2 трилон Б])– молярна концентрація еквівалента трилону Б, моль/дм3; V (трилон Б)– об’єм трилону Б, витрачений на реакцію з іонами Ca2+і Mg2+, см3;
V – об’єм проби води, см3.
Лабораторна робота 28
Визначення вмісту Кальцію та Магнію
 2017-12-14
2017-12-14 510
510








