Сутність визначення вмісту Кальцію та Магнію в розчині полягає в тому, що спочатку визначають сумарний вміст іонів Кальцію та Магнію, титруючи аналізований розчин трилоном Б за наявності індикатору хромогену чорного до одержання синього забарвлення, а титруючи розчин за наявності мурексиду, визначають вміст іонів Кальцію. За різницею цих двох визначень знаходять вміст іонів Магнію.
Реактиви, обладнання:0,0500 М (1/2 трилон Б) розчин трилону Б, амонійна буферна суміш (рН=10), індикатори хромоген чорний та мурексид, 2 М розчин NaОН, піпетки ємністю 5 та 25 см3, бюретка ємністю 25 см3, мірні циліндри, колба для титрування ємністю 250 см3.
Хід роботи
До 25 см3 досліджуваного розчину додамо 5 см3 амонійної буферної суміші, 0,025–0,03 г хромогену чорного та відтитруємо 0,0500 М (1/2 трилон Б)розчином трилону Б до переходу винно-червоного забарвлення в синє. Відтитруємо і Кальцій, і Магній, вміст яких обчислимо за відповідною формулою загальної твердості:
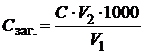 ,
,
де С заг. – загальна твердість води, ммоль-екв/дм3; С – молярна концентрація еквівалента трилону Б, моль/дм3; V 1 – об’єм трилону Б, витраченого на титрування суміші Кальцію та Магнію, см3; V 2 – об’єм суміші Кальцію та Магнію, узятої для титрування, см3.
|
|
|
До новоі порції 25 см3 даного розчину додамо 2,5 см3 2 М розчину гідроксиду натрію, 0,03–0,04 г мурексиду та відтитруємо трилоном Б до появи незникаючого протягом 2–3 хв фіолетового забарвлення.
За результатами титрування розрахуємо вміст Са2+-іонів у воді (ммоль-екв/дм3):
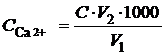 ,
,
де 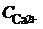 – вміст іонів Са2+, ммоль-екв/дм3; С – молярна концентрація еквівалента трилону Б, моль/дм3; V 1 – об’єм трилону Б, витраченого на титрування іонів Са2+, см3; V 2 – об’єм суміші Кальцію та Магнію, узятої для титрування, см3.
– вміст іонів Са2+, ммоль-екв/дм3; С – молярна концентрація еквівалента трилону Б, моль/дм3; V 1 – об’єм трилону Б, витраченого на титрування іонів Са2+, см3; V 2 – об’єм суміші Кальцію та Магнію, узятої для титрування, см3.
Вміст Mg2+-іонів у воді (ммоль-екв/дм3) визначимо за різницею
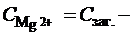
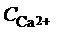
Контрольні запитання та завдання
1. Які хімічні сполуки називають комплексними?
2. У чому різниця між комплексними сполуками та подвійними солями?
3. Дайте визначення таких термінів: “комплексоутворювач”, “ліганд”, “координаційне число”.
4. Як обчислити заряд комплексного іона? Наведіть приклади.
5. Як кількісно характеризують стійкість комплексної сполуки?
6. Яке значення мають комплексні сполуки для аналізу?
7. Назвіть способи виявлення кінцевої точки в разі комплексонометричного титрування.
8. Що таке хелати?
9. Які вимоги повинні задовольняти металохромні індикатори? Напишіть рівняння рівноваги в розчині еріохрому чорного Т.
10. Як визначити вміст SO42--іонів у розчині за допомогою ЕДТА?
11. Назвіть стандартні речовини, які використовують для встановлення концентрації ЕДТА.
 2017-12-14
2017-12-14 408
408








