Газовий аналіз– це аналіз суміші газів із метою встановлення їх якісного та кількісного складу. Розрізняють хімічні, фізико-хімічні та фізичні методи газового аналізу. Перевага хімічних методів газового аналізу – простота конструкції приладів (газовизначників) та виконання аналізу.
В основі кількісного визначення компонентів газоподібної суміші лежать різні принципи. Одним із способів кількісного визначення газів є поглинання газу (найчастіше рідким середовищем) та аналіз одержаного розчину за допомогою, наприклад, титриметричного методу. Так, амоніак можна поглинати відміряним об’ємом хлоридної кислоти з відомим титром, яку потім відтитровують за допомогою деяких методів ацидометрії. Карбон(IV) діоксид можна поглинати в посудину з лугом (КОН) та кількісно визначати за збільшенням маси поглинача. Сульфур(IV) діоксид після поглинання розчином можна визначати йодометрично.
Інший спосіб кількісного визначення газів – предмет так званого газометричного аналізу (волюмометрії). У цьому випадку кількість газу визначають шляхом вимірювання його об’єму (тиску) в умовах сталого тиску (об’єму). Це визначення може бути пряме або непряме. При цьому поглинання компонентів газової суміші проводять за допомогою різних реагентів (табл. 4).
Таблиця 4
Адсорбівні речовини для деяких компонентів промислових газів
| Газ | Адсорбент |
| CO2, SO2 | KOH |
| CO | CuCl + Cu в аміачному або хлоридно- кислому розчині |
| O2 | Лужний розчин пірогалолу; Р |
| Ненасичені вуглеводні | Бромна вода; димляча H2SO4 |
| PH3, AsH3, SbH3 | AgNO3 |
| NH3 | H2SO4 (d = 1,7 г/см3 |
| NO | FeSO4 |
У разі застосування прямих газометричних методів об’єм визначуваного газу вимірюють безпосередньо після того, як із газової суміші видалені інші її компоненти, наприклад, у ході поглинання їх відповідними поглиначами. У випадку застосування непрямих газометричних методів після вимірювання загального об’єму суміші визначуваний компонент видаляють та знову вимірюють об’єм суміші. Об’єм визначуваного газу знаходять за різницею двох об’ємів.
Якщо необхідно визначити абсолютну кількість відповідного газу, то крім точного вимірювання його об’єму, слід знати ще тиск та температуру, за яких він був виміряний, щоб його можна було привести до нормальних умов згідно з рівнянням
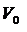 =
=  , (10)
, (10)
де V і Р – об’єм та тиск газу за температури Т (у К); V0 і Р0 – об’єм та тиск за нормальних умов (Р0 = 1 атм = 1,0132·105 Па = 760 мм рт. ст.).
Якщо взяти до уваги, що за нормальних умов один грам/моль будь-якого газу займає об’єм 22,41 л (V0), то можна обчислити абсолютну кількість газу в молях або грамах.
Якщо в процесі аналізу необхідно встановити вміст даного компонента в об’ємних відсотках у газовій суміші, то достатньо всі вимірювання провести за однакових температури та тиску – приводити виміряні об’єми до нормальних умов не обов’язково.
Крім визначення газів у різних газоподібних об’єктах, газовий аналіз успішно застосовують для дослідження рідких та твердих компонентів. Останні шляхом відповідної хімічної або термічної дії перетворюють на газоподібні речовини, які потім визначають методами газометричного аналізу.
Газометричний аналіз
Прилади, які в газовому аналізі використовуються для відбору проб та вимірювання їх об’єму, називають відповідно газовими піпетками та газовими бюретками. У них застосовується принцип сполучених посудин. Як рідину в них використовують насичені водяні розчини деяких солей (Na2SO4, NaCl), розчинність більшості газів у яких дуже мала. У тих випадках, коли необхідно визначити абсолютну кількість газу за його тиском, слід внести поправки на тиск пари рідини. Для цього в рівнянні (10) від тиску газу (Р) потрібно відняти значення парціального тиску рідини в бюретці. Якщо результати виражають в об’ємних відсотках, таке уточнення не потрібне, оскільки відносні зміни в об’ємах усіх компонентів, викликані наявністю пари рідини, будуть однакові й не впливатимуть на кінцевий результат.
За наявності твердих поглиначів наповнювач змішують з інертними твердими матеріалами (скляними волокнами, азбестом тощо) для того, щоб запобігти ущільненню та збільшити поверхню контакту газової та твердої фаз. Відміряну за допомогою газової бюретки пробу переганяють у піпетку з поглиначем доти, поки весь газ не буде поглинений, що встановлюють за припиненням зміни об’єму газової суміші. Об’єм газу визначають за різницею об’ємів до та після адсорбції.
Якщо суміш складається більше ніж із двох газів, використовують піпетки з різними поглиначами. Так, суміш, утворену із O2, CO2 і N2, послідовно переганяють через піпетки з концентрованим розчином КОН (30–50%) для поглинання CO2 і з лужним розчином пірогалолу для поглинання O2. Газ, який залишився після цього, – N2. За зменшенням об’єму газової суміші після кожного процесу поглинання можна визначити об’єм поглиненого газу та його вміст (%) у суміші.
Приклад 1. У ході аналізу газової суміші із O2, CO2 та N2 за вищеописаним способом виміряні такі об’єми (мл): вихідної газової проби – 80,0;після поглинання CO2 – 35,5; після поглинання O2 – 12,4. Визначимо склад газової суміші в об’ємних відсотках:
[CO2] =  ;[O2] =
;[O2] =  ;
;
[N2] =  .
.
Об’ємні хімічні газоаналізатори зазвичай використовують для вимірювання концентрації СО, СО2, О2, SO2, NH3, насичених та ненасичених вуглеводнів. Похибка приладів складає ±(0,1–0,2)% об’єму проби. За наявності гранично низьких та низьких надлишків повітря дуже важливо вміти визначати їх із високою точністю. Для визначення найчастіше використовують хімічні газоаналізатори типу Орса (ГХП-ЗМ), а останнім часом – магнітні киснеміри. Точність вимірювання вмісту кисню газоаналізаторами ГХП-ЗМ поки що не встановлена і, як правило, її ототожнюють із точністю відліку, тобто вона береться такою, що дорівнює 0,2 абс. %. У той же час за даними зарубіжних дослідників за допомогою апарата Орса можна визначати кисень лише з точністю 0,5 абс. %. На думку Г. Ф. Кнорре, така ж точність може бути досягнута і в разі використання газоаналізатора ВТІ-2, де результат аналізу подається з точністю 0,05 абс. %.
Найбільш простий із переносних ручних газоаналізаторів – вищезазначений апарат Орса, який являє собою комбіновану систему з декількома абсорбційними піпетками та газовою бюреткою. Ціна поділки газової бюретки – 1 мм. Вона з’єднується резиновою трубкою з порівнювальною склянкою, заповненою водою. Піднімаючи або опускаючи цю склянку, можна змінювати рівень рідини в бюретці й таким чином змінювати вільний об’єм газу. Бюретка в її верхній частині сполучається з поглинальними посудинами.
За допомогою апарата Орса можна визначати вміст (% об.) у відхідних газах печі (СО2, СО, О2), які не брали участь у згорянні палива. За процентами СО2, СО та О2 можна робити висновки про надлишок повітря в печі, а за процентом СО – про повноту згоряння палива. Якщо сума СО2 + О2 буде менша за максимальний процент СО2, то згоряння неповне. У разі повного згоряння газу сума СО2 + О2 повинна дорівнювати або бути більшою за максимальний процент СО2, і чим вона буде більша, тим із більшим надлишком повітря проходить спалювання палива. Висновки про повноту згоряння за сумою СО2 + О2 зручно робити, тому що в апараті Орса аналіз газів на СО проводять останнім, і реактив на його визначення дуже нестійкий. Тому, якщо відомий процент СО2 та СО2 + О2 процент СО легко визначити.
Деякі компоненти природних та промислових газових сумішей, таких як гідроген та насичені вуглеводні, для визначення яких немає зручних абсорбційних методів, можна визначити, змішавши їх із киснем та спаливши в спеціальній піпетці. Спочатку в піпетку вводять точно виміряний об’єм кисню і за допомогою електричного струму нагрівають платиновий дріт. Потім через капіляр повільно пропускають газ, горючі компоненти якого згоряють під час контакту з дротом. Згоряння можна здійснити за допомогою електричної іскри у спеціальних апаратах – евдіометрах.
Кількість горючих компонентів визначають шляхом вимірювання об’єму CO2, утвореного після згоряння, за об’ємом кисню, поглиненого в ході згоряння, або за загальним зменшенням об’єму після згоряння.
Так, у результаті згоряння Н2 згідно з рівнянням
2Н2 + O2 → 2Н2O
об’єм Н2 дорівнюватиме подвоєному об’єму витраченого O2. Оскільки об’єм води, сконденсованої у вигляді крапель, дуже малий, то можна вважати, що об’єм Н2 буде дорівнювати двом третинам від загального зменшення об’єму газової суміші.
У результаті згоряння метану згідно з рівнянням
СН4 + 2O2 → СО2 + 2Н2O
об’єм СН4 дорівнює половині об’єму O2, витраченого в результаті згоряння, або половині від загального зменшення об’єму в ході реакції (в реакції підсумовуються три об’єми газу, а утворюється один об’єм, таким чином, різниця дорівнює двом об’ємам. Об’єм СН4 можна знайти й із об’єму одержаного СО2, оскільки згідно з рівнянням вони однакові.
Дані про зміну параметрів, за якими можна знайти вміст газу після згоряння, уміщені в табл. 5.
Приклад 2. Суміш, утворена із C2H6, СО2 та N2, має об’єм 30,0 мл. Після поглинання СО2 у розчин КОН він складає 15,0 мл. До цього залишку додамо 80,0 мл O2 і спалимо суміш. Її об’єм після згоряння дорівнюватиме 75 мл. Знайдемо склад газової суміші в об’ємних відсотках, використовуючи дані табл. 5.
Розв’язання. Із умови випливає, що V(C2H6) + V(СО2) + V(N2) = 30,0 мл; об’єм СО2 дорівнює: 30,0 – 15,0 = 15,0 мл. Зменшення об’єму після згоряння: (15,0 + 80,0) – 75,0 = 20,0 мл. Згідно з даними табл. 5 для C2H6: 5/2V = 20,0 мл, і тоді V(C2H6) = 8,0 мл. Об’єм N2, таким чином, дорівнює: 30,0 – 15,0 – 8,0 = 7,0 мл. Вміст (% об.) газів у суміші складає
[C2H6] =  ;[СO2] =
;[СO2] =  ;
;
[N2] = 
Таблиця 5
Зміна об’ємів газів у процесі згоряння
| Газ | Реакція згоряння | Об’єм газу | Витрачений об’єм | Об’єм газової суміші після згоряння | СО2, що утворився |
| H2 | 2Н2 + O2 → 2Н2O | V | 1/2V | 3/2V | – |
| C2H2 | 2C2H2 + 5O2 → 4СО2 + 2Н2O | V | 5/2V | 3/2V | 2V |
| CH4 | СН4 + 2O2 → СО2 + 2Н2O | V | 2V | 2V | V |
| C2H6 | 2C2H6 + 7O2→ 4СО2 + 6Н2O | V | 7/2V | 5/2V | 2V |
| C4H10 | 2C4H10 + 13O2→ 8СО2 + 10Н2O | V | 13/2V | 7/2V | 4V |
| CO | 2CO + O2 → 2СО2 | V | 1/2V | 1/2V | V |
Приклад 3. У процесі нагрівання суміші карбонату магнію та перманганату калію утворилося 11,2 дм3 газової суміші (н. у.), яка має густину за повітрям 1,27. Обчислимо: а) масовий склад вихідної суміші солей; б) об’ємні частки компонентів газової суміші (%).
Розв’язання. МgСО3 = MgO + СО2,
2КМnO4 = К2МnO4 + МnO2 + O2.
Молярна маса суміші
М(сум.)= 1,27∙29 = 36,83 (г/моль).
Припустимо, що в 1 моль утвореної газової суміші міститься х моль СО2 і (1 - х)моль О2.Тоді
36,83 = 44 х + 32∙(1 - х),
звідси х = 0,4025 (моль).
χ (СО2) = φ (СО2) = 40,25 (%), χ (О2) = φ (О2) = 100 - 40,25 = 59,75 (%).
Об' єми газів в утвореній суміші становитимуть
V(СО2) = 11,2∙0,4025 = 4,508 (л), V(О2)= 11,2 - 4,508 = 6,692 (л)
За рівняннями реакцій розрахуємо масовий склад вихідної суміші:
а г4,508л
МgСО3= MgO + СО2↑; а = 16,9 (г);
84г22,4л
b г6,692л
2KMnО4 = K2MnО4 + MnО2 + О2↑; b = 94,4 (г).
316г 22,4л
Відповідь: 94,4 г KMnО4, 16,9 г МgСО3; 40,25 % СО2, 59,75 % О2.
Газогенний аналіз
Газогенний аналізпередбачає визначеннядеяких компонентів рідких та твердих проб за допомогою методів газометричного аналізу, або газової хроматографії, після перетворення цих компонентів на відповідні гази. Даний метод широко застосовують для визначення карбонатів у природних зразках. Для цього наважку розкладають малим об’ємом розведеної кислоти і, після попереднього висушування або поправки на парціальний тиск пари води, вимірюють об’єм СО2, який виділяється. Цей же метод, відомий як метод Кнопа-Вагнера, застосовують у разі визначення солей амонію: іони NH4+ перетворюють на N2 за реакцією
2NH4+ + 2ОН- + 3BrO- → N2 + 5Н2O + 3Br-
та вимірюють об’єм N2, що утворився. Визначення нітратів за допомогою газогенного методу (відомого як метод Лунге) ґрунтується на їх відновленні в сульфатнокислому середовищі до NО за допомогою елементарної ртуті
NО3- + 8Н+ + 6Hg → NO2 + 4Н2O + 3Hg22+
та вимірюванні об’єму NО, який виділився. Для визначення вмісту нітрогену в органічних сполуках зазвичай застосовують газогенний метод Дюма. За цим методом речовину, що аналізують, змішують із СuO та прожарюють до темно-червоного кольору в трубці, через яку повільно пропускають СО2. У результаті органічна проба окиснюється до СО2, Н2O, N2 та оксидів Нітрогену. Для відновлення останніх до N2 у кінець трубки поміщають мідну сітку та нагрівають її. Газ пропускають через поглинач із КОН, який затримує СО2, після чого вимірюють об’єм N2,одержаного в ході реакції.
 2017-12-14
2017-12-14 684
684








