По характеру углеводородного радикала различают: алифатические и ароматические карбоновые кислоты.

По характеру расположения аминогруппы различают:  и т.д аминокислоты.
и т.д аминокислоты.

- 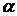 - аминокислоты, которые не синтезируются в организме человека и некоторых животных, но важны для него, - относят к незаменимым кислотам, это основные аминокислоты: валин, лейцин, изолейцин, лизин, треонин, метионин, фенилаланин, триптофан. Частично заменимые: тирозин, гистидин. Заменимые (аланин, аспарагиновая, глицин, глутаминовая, гидроксипролин, пролин, серин).
- аминокислоты, которые не синтезируются в организме человека и некоторых животных, но важны для него, - относят к незаменимым кислотам, это основные аминокислоты: валин, лейцин, изолейцин, лизин, треонин, метионин, фенилаланин, триптофан. Частично заменимые: тирозин, гистидин. Заменимые (аланин, аспарагиновая, глицин, глутаминовая, гидроксипролин, пролин, серин).
При некоторых заболеваниях организма число таких кислот расширяется: например, при фенилкетонурии – организм не синтезирует тирозин.
В зависимости от радикалов аминокислоты подразделяются на несколько классов.
| Аминокислоты | Символ | Структура | Функция |
| Моноаминомонокарбоновые аминокислоты | |||
| Глицин | Gly-G | Н2N-СН2-СООН | Принимает участие в синтезе нуклеиновых кислот, глутатиона, порфиринов. Участвует в механизме дотоксикации, в образовании желудочной кислоты, в синтезе креатина, пиррола, в синтезе витамина В3, входит в состав КоА. |
| Аланин | Ala-A | Н2N-CH-COOH │ CH3 | Является глюкогенной кислотой т.к легко переходит в жирорастворимую кислоту. |
| Валин | Vol-V | H2N-CH-COOH │ CH / \ CH3 CH3 | Незаменимая аминокислота.Содержится во многих белках, но в малых количествах. Играет очень важную роль при синтезе белка в рибосомах, при построении пространственной структуре белка, при действии ферментов. |
| Изолейцин | Ne-I | H2N-CH-COOH │ CH / \ CH3 CH2 \ CH3 | Незаменимая аминокислота.. Является кетогенной аминокислотой, источником ацетил-КоА для синтеза жирных кислот. |
| Лейцин | Leu-L | H2N-CH-COOH │ CH2 │ CH / \ CH3 CH3 | Незаменимая аминокислота. Содержится во многих белках. Играет важную роль при синтезе белка в рибосомах, при построении пространственной структуры белка и действии ферментов. |
| Неароматические аминокислоты с гидроксильными R-группами | |||
| Серин | Ser-S | H2N-CH-COOH │ CH2 │ OH | Входит в состав белка казеина, фосфолипидов, Легко поддается фосфорилированию по месту нахождения ОН- группы |
| Треонин | Thr-T | H2N-CH-COOH │ CH / \ CH3 OH | Незаменимая аминокислота. Фосфорилируется по месту нахождения ОН- группы. |
| Аминокислоты с серосодержащими R-группами | |||
| Цистеин | Cys-C | H2N-CH-COOH │ CH2─SH | Наличие SH-группы определяет антиоксидантные свойства этой аминокислоты при воздействии разного рода токсических веществ. |
| Цистин | H2N-CH-COOH │ CH2─S / CH2─S / H2N-CH-COOH | Наличие SH-группы определяет антиоксидантные свойства этой аминокислоты при воздействии разного рода токсических веществ | |
| Метионин | Met-M | H2N-CH-COOH │ CH2 │ CH2─S─CH3 | Незаменимая аминокислота. Наличие метильного радикала (СН3) определяет важную роль этой аминокислоты как донора метильных групп (синтез ДНК). |
| Моноаминодикарбоновые аминокислоты | |||
| Аспарагиновая кислота | Asn-N | H2N-CH-COOH │ CH2 │ COOH | Обладает способностью к амидированию место нахождения карбоксильной группы и превращается в аспарагин. |
| Глютаминовая кислота | Glu-E | H2N-CH-COOH │ CH2 │ CH2 │ COOH | Является донаторами NН2 групп при синтезе аминокислот (периаменирование). |
| Диаминомонокарбоновые аминокислоты | |||
| Лизин | Lus-K | H2N-CH-COOH │ CH2 │ CH2 │ CH2 │ CH2─NH2 | Принадлежит важная роль в связывании Р и минерализации костной ткани |
| Аргинин | Arg-R | H2N-CH-COOH │ CH2 │ CH2 │ NH ║ CH2 ─NH─C─NH2 | Незаменимая аминокислота. Недостаток аргени на может привести к задержке роста, к нарушению процессов биосинтеза. |
| Аминокислоты с ароматическим кольцом | |||
| Фенилаланин | Phe-F |  | Незаменимая аминокислота. Под действием фермента фенилаланина 4-гидроксилазы фенилаланин превращается в тирозин. |
| Тирозин | Tyr-Y | 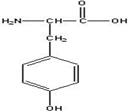 | Незаменимая кислота Является предшественником ряда гормонов: тероксина(гормон щитовидной железы). |
| Триптофан | Trp-W | Незаменимая кислота является предшественником нейромедиаторов. | |
| Гистидин |  | Содержится в больших количествах в гемоглобине. При декарбоксилировании преобразуется в активный амин-гистамин. | |
| Иминокислоты | |||
| Пролин | Pro-P |  | Содержится в продуктах распада многих белков. Предшественник оксипролина (4-оксипироллидин α-карбоновая кислота), который является важнейшим компонентом при построении соединительной ткани. |
| Изопролин |  |
Кроме перечисленных в таблице аминокислот существует так же целый ряд других аминокислот, которые не когда не в ходят в состав белков: β-аланин, λ-аминомасляная кислота, β-цианоаланин, метилгистидин.
В практике корма могут быть наиболее дефицитными по трем аминокислотам – лизину, метионину и триптофану. Как правило, корма, богатые энергией (зерновые), содержат эти аминокислоты сравнительно в малом количестве, поэтому такого рода корма необходимо пополнить такими белковыми добавками, которые содержат эти аминокислоты в достаточном количестве. У полигастричных животных (жвачные) потребность в незаменимых аминокислотах выражена в меньшей степени, чем у моногастричных животных. Однако в период лактации у жвачных может возникнуть потребность в пополнении их рациона нужными незаменимыми аминокислотами.
Аминокислоты используются в качестве лекарств:
Глутаминовая кислота - является предшественником гамма-аминомасляной кислоты (ГАМК), являющейся тормозным медиатором нервной системы. Сам глутамат также является нейромедиатором, стимулирующим передачу возбуждения в синапсах ЦНС. Кроме этого, глутамат участвует в обезвреживании аммиака, синтезе пуриновых и пиримидиновых оснований, играет ведущую роль в обмене других аминокислот, что активно используется в спортивной медицине. Потребность организма в глутаминовой кислоте намного выше потребности в остальных аминокислотах.
Метионин, незаменимая аминокислота, содержит мобильную метильную группу, которая может передаваться на другие соединения. Благодаря этому она участвует в синтезе холина, фосфолипидов, обмене витаминов В12 и фолиевой кислоты. В реакциях биосинтеза белка метионин является инициирующей аминокислотой. Он участвует в процессах обезвреживания токсинов в печени. Метионин и его аналоги используют для профилактики заболеваний печени как липотропный фактор, препятствующий накоплению жира при токсических поражениях, циррозе, атеросклерозе.
Глицин является медиатором ЦНС тормозного действия. Улучшает метаболизм в тканях мозга. Оказывает успокаивающее действие. Нормализует сон, уменьшает повышенную раздражительность, депрессивные состояния.
Гистидин - условно незаменимая аминокислота. Используется при лечении гепатитов, язв желудка и двенадцатиперстной кишки.
Цистеин участвует в метаболизме хрусталика глаза. Зачастую нарушения хрусталика связаны с недостатком цистеина, поэтому цистеин применяют на начальных стадиях катаракты.
Вицеин - комплексный препарат глутаминовой кислоты, цистеина и глицина. Используют в виде глазных капель.
Церебролизин - гидролизат вещества мозга свиньи, содержащий низкомолекулярные пептиды (15%) и аминокислоты (85%). Используется при нарушениях функций ЦНС, мозговых травмах, кровоизлияниях, вегетативных дистониях и т.п.
Препараты для парентерального питания: полиамин (набор 13 аминокислот), вамин (набор 18 аминокислот), ваминолакт (набор 18 аминокислот, соответствующих составу грудного молока), гидролизин (гидролизат белков крови крупного рогатого скота), аминотроф (гидролизат казеина), фибриносол (гидролизат фибрина крови).
Цель: Изучить классификацию белков, их состав и свойства.
Белки подразделяются на две большие группы: простые белки, или протеины, и сложные белки, или протеиды, состоящие из белковой (апобелок) и небелковой частей (простетическая группа).

Протеины представляют собой простые белки, состоящие только из белковой части. Они широко распространены в животном и растительном мире.
Альбумины и глобулины встречаются практически во всех животных и растительных клетках, биологических жидкостях и выполняющих важные биологические функции. Альбумины хорошо растворяются в воде. Встречаются в молоке, яичном белке и крови. Глобулины в воде не растворяются, но растворимы в разбавленных растворах солей. К глобулинам принадлежат глобулины крови и мышечный белок миозин.
Глутелины растворяются только в разбавленных растворах щелочей. Встречаются в растениях.
Склеропротеины — нерастворимые белки. К склеропротеинам относятся кератины, белок кожи и соединительных тканей коллаген, белок натурального шелка фиброин.
Протамины и гистоны. Протамины обладают выраженными основными свойствами, обусловленными наличием в их состав от 60 до 85% аргинина. Например, сальмин, выделенный из молок семги, состоит на 85% из аргинина. Протамины хорошо растворимы в воде, изоэлектрическая точка находится в щелочной среде. Эти белки, вероятно, являются пептидами, так как их молекулярная масса не превышает 5000. Они составляют белковый компонент в структуре ряда сложных белков.
Гистоны также являются белкам и основного характера. В их состав входит лизин и аргинин, до 20-30%. Эти белки локализованы в ядрах клеток в составе дезоксиребонуклеопротеинов и играют важную роль в экспрессии генов.
Проламины и глютелины. Это белки растительного происхождения. Они содержаться в основном в семенах злаков (пшеница, рожь, ячмень), составляя основную массу клейковины. Наиболее изучены оризенин (из риса), глютенин и глиадин (из пшеницы), зеин (из кукурузы) и др. Установлено что эти белки содержат 20-25% глутаминовой кислоты и 10-15% пролина.
Альбумины и глобулины. Эти белки широко распространены в органах и тканях животных. Наиболее богаты ими белки сыворотки крови. молока, яичный белок, мышцы и др. Альбумины и глобулины – это глобулярные белки, различающиеся по растворимости. Различают растворимость этих белков сыворотки крови широко используют в клинической практике для их фракционирования и количественного определения.
Альбумин организован из 575 аминокислотных остатков, и его молекулярная масса составляет 40000-70000. Молекула белка имеет низкую изоэлектрическую точку (рН 4,7) и высокий отрицательный заряд при рН 8,6, благодаря чему он мигрирует с большой скоростью в электрическом поле к аноду. Принято считать, что примерно 75-80% осмотического давления белков сыворотки крови приходится на альбумины. Альбумины участвуют в транспорте жирных кислот. Однако точная функция альбуминов до конца не выяснена. Известны случаи, когда в крови фактически отсутствуют альбумины (врожденная аномалия), но люди были практически здоровы.
Глобулины представлены α-, β- и γ-фракциями. α-фракции содержаться в крови в комплексе с билирубином и липопротеидами высокой плотности. β-глобулины включают ряд важных функциональном отношении белков, в частности трансферрин – белок ответственный за транспорт и запасание железа. С этой фракцией связан церулоплазмин – белок, транспортирующий ионы меди. В этой фракции присутствует протромбин, являющийся предшественником тромбина – белка, ответственного за превращение белка фебриногена крови в фибрин при свертывание крови. Фракция γ-глобулинов (иммуноглобулины) является наиболее гетерогенной. Известно множество антител (иммуноглобулины), различающихся первичной структурой и функциональной нагрузкой в реализации иммунного ответа организма.
Протеиды построены из протеинов, соединенных с молекулами другого типа (простетическими группами).
Сложные белки в зависимости от строения простетической группы подразделяются на 6 классов.
1. Липопротеиды. Имеют в своем составе липидный компонент. Участвуют в транспорте липидов. Структурные компоненты клеточных мембран. По соотношению белкового и липидного компонентов липопротеиды делятся на хиломикроны (на белок приходится не более 2% молекулярной массы), липопротеиды очень низкой плотности (около 10% белка), липопротеиды низкой плотности (не менее 20% белка), липопротеиды промежуточной плотности, липопротеиды высокой плотности (около 50% белка).
2. Гликопротеиды. В качестве простетической группы присутствует углеводный компонент, присоединенный к белку гликозидной связью. Основная функция гликопротеидов – рецепторная. Многие гормоны являются гликопротеидами. Некоторые вирусы способны нарушать структуру гликопротеидов. Гликопротеиды входят в состав хрящей, рогов, слюны.
3. Нуклеопротеиды. Простетическая группа – ДНК или РНК. Эти белки принимают участие в образовании хромосом, полисом, рибосом. Нуклеопротеидами являются белки-гистоны, образующие комплексы с нуклеиновой кислотой. Они представляют собой очень важные с биологической точки зрения белки - составные части клеточных ядер. Нуклеопротеиды являются важнейшей составной частью вирусов — возбудителей многих болезней.
4. Хромопротеины. Простетическая группа – окрашенное соединение, хотя по строению оно может быть различным. Гемоглобин, миоглобин и цитохромы содержат ген, включающий атом железа, и участвуют в окислительно-восстановительных реакциях, связанных с кислородом. Флавопротеиды имеют в своем составе витамин В2 (рибофлавин).
5. Металлопротеиды. Простетическая группа – атом металла. Функция, как правило, состоит в транспорте или депонировании соответствующего металла. Так, сывороточный ферритин участвует в транспорте и накоплении железа, церулоплазмин – меди.
6. Фосфопротеиды. Простетическая группа представлена фосфатом, присоединенным к оксигруппе аминокислот серина и треонина. Фосфаты увеличивают заряд белковой молекулы, а значит, и его растворимость. Фосфопротеидов весьма много в молоке, благодаря чему молочный белок (казеин) легко усваивается.
Существует несколько классификаций белков. В основе их лежат разные принципы: по степени сложности (простые и сложные); по форме молекул (глобулярные и фибриллярные белки); по растворимости в отдельных растворителях (водорастворимые, растворимые в слабых солевых растворах — альбумины, спирторастворимые — проламины, растворимые в щелочах — глютелины), по выполняемым ими функциям, например запасные белки, скелетные и т. д.
Контрольные вопросы
- Общая структурная формула аминокислот.
- Сколько аминокислот обнаружено в белках животного происхождения.
- Две основные группы аминокислот, отличающиеся структурой.
- Подгруппы аминокислот, относящихся к ациклическим.
- Назовите моноаминомонокарбоновые аминокислоты.
- Назовите моноаминодикарбоновые аминокислоты.
- Назовите диаминокарбоновые аминокислоты.
- Назовите аминокислоты, содержащие сульфгидрильную дисульфидную группу.
- Назовите аминокислоты, производные гетероциклических соединений.
- Назовите аминокислоты, производные гомоциклических произведений.
- Как принято сокращенно записывать названия аминокислот.
- Назовите аминокислоты, обладающие кислыми (основными) свойствами.
Химические формулы всех аминокислот, входящих в состав белков, необходимо запомнить!
- Чем обусловлена амфотерность аминокислот?
- Дать определение белков?
- Назвать важнейшие функции белков, привести примеры?
- Какова молекулярная масса белков?
- Назовите белки кислого и основного характера?
- Что такое изоэлектрическая точка (ИЭТ) и почему она различная для различных белков?
32. Значение реакции осаждения белков для ветеринарии и медицины?
33. Дать определение: 1) первичной, 2) вторичной, 3) третичной, 4) четвертичной структурной организации молекул белка. Привести примеры белков. Чем обусловлены перечисленные структуры белковой молекулы?
34. Каково химическое строение белков?
35. Классификация белков?
36. Дать определение, характеристику, рассказать о свойствах, нахождении в организме и значении следующих простых белков- протеинов:
а) альбуминов и глобулинов (α, β, γ);
б) гистонов, протаминов;
в) глютелинов, проламинов;
г) протеиноидов (коллагенов, кератинов, эластинов, фибриона).
37. Дать характеристику, определение, рассказать о химическом строении, свойствах, локализации в организме и значении следующих сложных белков – протеидов:
а) в чем отличие гемоглобина от оксигемоглобина, метгемоглобина, карбогемоглобина, и карбоксигемоглобина?
б) хромопротеидов (гемоглобина, меоглобалина, каталазы, цитохромов, цитохром оксида);
в) фосфопротеидов (казеина, пептина, фосфоовитина, овоальбумина);
г) гликопротеидов (муцины, мукоиды);
д) липопротеидов (α, β- липопротеиды, липовителины, фосфолипиды + белок;
е) нуклеопротеидов.
38. В чем отличие сложных белков (протеидов) от простых (протеинов)?
Лабораторная работа
Все реакции на белки основаны на наличии в них определенных химических групп и на физико-химических свойствах. Реакции на белки можно разделить на две самостоятельные группы: цветные реакции и реакции осаждения белков.
 2018-01-08
2018-01-08 1646
1646
