Получим выражение для внутренней энергии и теплосодержания единицы массы жидкости.
Внутренняя энергия единицы массы U зависит от параметров состояния. Так как p, V, T связаны уравнением состояния, то независимыми переменными являются только какие-нибудь два из них, и можно считать: U = U (V, T), где 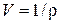 .
.
Отсюда полный дифференциал внутренней энергии равен

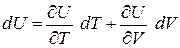 . (3.18)
. (3.18)
Чтобы иметь возможность проинтегрировать уравнение (3.18) и получить расчетную формулу для внутренней энергии, нужно определиться с частными производными 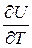 и
и 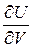 .
.
Согласно первому закону термодинамики
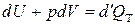 , (3.18а)
, (3.18а)
где 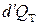 – количество тепла, получаемое единицей массы жидкости за время
– количество тепла, получаемое единицей массы жидкости за время 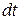 (
(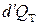 не является полным дифференциалом). Исключив из выражения (3.18) и (3.18а) дифференциал
не является полным дифференциалом). Исключив из выражения (3.18) и (3.18а) дифференциал 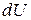 , имеем следующее:
, имеем следующее:
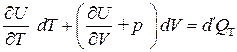 . (3.19)
. (3.19)
Введем понятие удельной теплоемкости с как физической величины, численно равной количеству тепла, которое необходимо сообщить (отнять) единице массы жидкости, чтобы изменить ее температуру на 1 К:
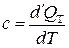 .
.
Если тепло подводить к единице массы жидкости, сохраняя постоянным объем, то удельную теплоемкость называют теплоемкостью при постоянном объеме – 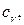 если тепло подводить при p = const – то теплоемкостью при постоянном давлении –
если тепло подводить при p = const – то теплоемкостью при постоянном давлении – 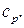 В условиях, далеких от сжижения газов, теплоемкость зависит от температуры газа и почти не зависит от давления. Тогда выражение для
В условиях, далеких от сжижения газов, теплоемкость зависит от температуры газа и почти не зависит от давления. Тогда выражение для 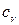 имеет вид
имеет вид
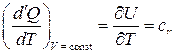 .
.
Таким образом, определился первый коэффициент уравнения (3.18). Для определения 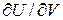 воспользуемся выражением для дифференциала энтропии. Энтропия – это функция, которая определяется следующим дифференциальным уравнением:
воспользуемся выражением для дифференциала энтропии. Энтропия – это функция, которая определяется следующим дифференциальным уравнением:
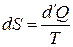 .
.
Процессы, протекающие без теплообмена и при отсутствии потерь механической энергии, т. е. при S = const называются изоэнтропическими. С учетом уравнения (3.19) имеем следующее:
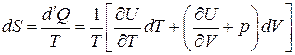 .
.
Так как dS – полный дифференциал, то накрест взятые частные производные от коэффициентов при dT и dV должны быть равны между собой. То есть
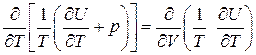 .
.
После дифференцирования 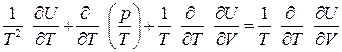 и сокращения получаем
и сокращения получаем 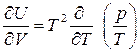 . Для дальнейшего преобразования воспользуемся уравнением состояния. Для идеальных газов
. Для дальнейшего преобразования воспользуемся уравнением состояния. Для идеальных газов 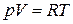 . Отсюда
. Отсюда 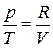 , т. е.
, т. е. 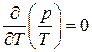 и
и 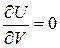 . Для реальных газов, подчиняющихся уравнению состояния Ван-дер-Ваальса
. Для реальных газов, подчиняющихся уравнению состояния Ван-дер-Ваальса
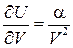 .
.
Теперь можно получить выражения для внутренней энергии (для идеального и реального газа):
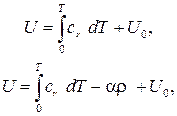 (3.20)
(3.20)
где 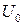 – внутренняя энергия жидкости при температуре Т = 0 К; для идеального газа
– внутренняя энергия жидкости при температуре Т = 0 К; для идеального газа 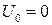 .
.
Установим связь между теплоемкостями 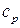 и
и 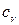 . Если уравнение состояния идеального газа разрешить относительно V, то получим
. Если уравнение состояния идеального газа разрешить относительно V, то получим
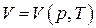 и
и 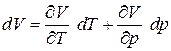 .
.
Из выражения (3.19) можно записать следующее:
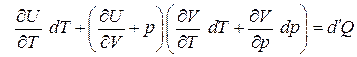 .
.
Тогда при p = const
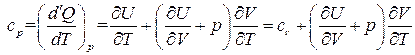 .
.
Для идеальных газов 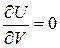 ; из уравнения состояния
; из уравнения состояния 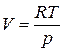 и
и 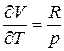 . Отсюда
. Отсюда 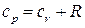 . Отношение удельных теплоемкостей обозначим
. Отношение удельных теплоемкостей обозначим 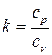 , тогда
, тогда 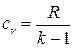 , а
, а 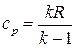 .
.
Для реальных газов 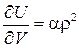 ,
, 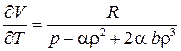 и
и 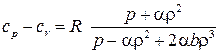 .
.
С учетом полученных зависимостей выражение для теплосодержания единицы массы неподвижного идеального газа (энтальпии) следующие:
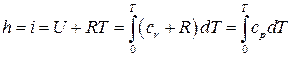 .
.
Считая, что 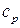 не зависит от температуры, выражение для энтальпии можно представить следующим образом:
не зависит от температуры, выражение для энтальпии можно представить следующим образом:
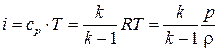 .
.
Получим выражение для энтропии идеального газа. Так как 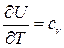 ,
, 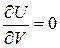 и
и 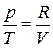 , то, считая R и
, то, считая R и 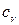 постоянными, выражение для дифференциала энтропии можно привести к виду
постоянными, выражение для дифференциала энтропии можно привести к виду
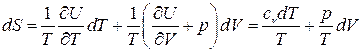 ,
,
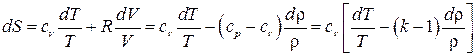 ,
,
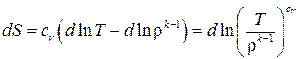 .
.
После интегрирования получаем следующее:
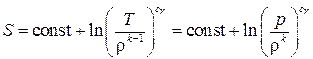 . (3.21)
. (3.21)
Если рассматривается изоэнтропический или адиабатический процесс, для которого характерно постоянство энтропии (S = const), то и второе слагаемое в выражении (3.21) должно быть неизменным, т. е.
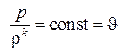 . (3.22)
. (3.22)
Выражение (3.22) носит название адиабаты Пуассона, и в соответствии с этим показатель степени в этом выражении k называют показателем адиабаты. Соотношение (3.22) имеет место в частице, и 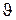 может изменяться от частицы к частице. При установившемся движении
может изменяться от частицы к частице. При установившемся движении 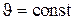 на линии тока.
на линии тока.
Предположение о постоянстве 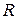 и
и 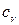 , при котором получено соотношение (3.22), справедливо в определенном диапазоне температур, зависящем от физических свойств газа. Величина показателя адиабаты
, при котором получено соотношение (3.22), справедливо в определенном диапазоне температур, зависящем от физических свойств газа. Величина показателя адиабаты 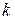 зависит от структуры молекул газа: для одноатомных газов
зависит от структуры молекул газа: для одноатомных газов 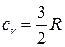 и
и 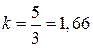 ; для двухатомных, к которым можно отнести и воздух,
; для двухатомных, к которым можно отнести и воздух, 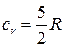 и
и 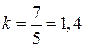 ; для трехатомных
; для трехатомных 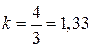 .
.
Интегралы дифференциальных уравнений Эйлера
В общем виде дифференциальные уравнения движения Эйлера не интегрируются. Их интегралы можно найти только для некоторых частных случаев. Рассмотрим порядок нахождения интегралов:
1) для потенциального неустановившегося движения;
2) для установившегося непотенциального движения сжимаемого газа.
 2015-03-22
2015-03-22 1690
1690
