К концу 19в. Накопилось много сведений говорящих о сложном строении атома:
· Открытие рентегоновских лучей в 1895г
· Беккерель натолкнулся на явление естественной радиоактивности
· Супруги Кюри, Беккерель, Разерфорд за учение о радиоактивности получили Нобелевские премии
· Благодаря супругам Кюри открыли радий и полоний
Косвенное доказательство сложности строения атома – открытие периодического закона.
Таким образом, встал вопрос о модели строения атома. Одной из первых модели была модель, предложенная Томсоном (1903г.). Он предложил «пудинг с изюмом» (статическая модель).
Море положительного электричества
Вкрапления электронов, находящиеся в постоянном
положении
В 1911г. Разерфорд, чтобы проверить эту теорию обстреливал положительно заряженными пулями атом золота. Оказалось, что большая часть альфа- частиц (+) свободно пролетают через атомы золота, которые дают вспышку за пластинкой. Только 1/1000 альфа- частиц отрикошечивает от пластинки и дает вспышку перед пластинкой, встречаясь с ионом (+).
На основании результатов этого эксперимента Разерфорд предложил следующую модель:
1.В центре атома находится «+» заряженное, малое по объему, сосредоточившее в себе почти всю массу атома ядро
2.Вокруг ядра по орбитам вращаются электроны
3.Положительный заряд ядра компенсируется суммарным отрицательным зарядом электронов, атом нейтрален
4.Центробежные силы, возникающие при вращении электронов, уравниваются электростатическим притяжением электронов к ядру.
Недостатки теории Разерфорда:
1.Не объясняет устойчивости атома, т.е. почему электрон не падает на ядро
2.Не объясняла природу атомных спектров (атомные сперктры, в отличие от молекулярных, содержат не все цветные линии и имеют черные промежутки между линиями).
3.По теории электрон испускает энергию непрерывно, поэтому в спектре должны быть все возможные цветные полосы, и не должно быть черных промежутков.
У каждого элемента свой атомный спектр («паспорт» элемента).
Теория Бора 1913г.:
Бор взял за основу структурную идею атома Резерфорда и приложил к ней квантовую теорию света, и попытался объяснить природу атомных спектров. Квантовая теория бала предложена в 1900г М.Планком. Он пришел к выводу, что свет испускается порциями – квантами.
Екванта = hv, где v – частота светоиспукания, а h – постоянная Планка
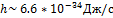
Постулаты Бора:
1.Электрон в атоме может двигаться только по стационарным орбиталям.
2.Двигаясь по орбиталям, электрон не излучает и не поглощает энергию.
3.Излучение или поглощение энергии происходит при переходе электрона с одной орбитали на другую.
a. Электрон, удаляясь от ядра, энергию поглощает.
b. Электрон, приближаясь к ядру, энергию выделяет.
Таким образом, у каждого электрона есть несколько стационарных орбиталей.
Благодаря теории, Бор рассчитал спектр атома Н (положение цветных полос в спектре). Рассчитанный спектр полностью совпал с экспериментальным. Бор даже предсказал полосы в невидимых частях спектра, и их там обнаружили.
Недостатки теории Бора:
1.Противоречие с классической физикой: движущаяся частица не может не излучать энергию.
2.Внутренне противоречие: не известно, где находится электрон, когда переходит с одной орбитали на другую (т.к.к он может находиться только на стационарных орбиталях, а между ними –нет).
Современная модель строения атома (квантово-механическая/электронно-волновая модель)
В 1924г. французский ученый-физик Луи де Бройль предложил уравнение, которое описывает поведение электронов:
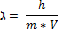
ℷ - длина электронной волны (лямбда) = 10-8 см
m – масса электрона
V – скорость электрона = 20000 м/с
h –постоянная Планка
Это уравнение говорит о том, что электрону присуща корпускулярно-волновая двойственность: присущи свойства частицы и свойства волны. Волновые свойства электрона были экспериментально доказаны в 1927г. Аналогом электронной волны можно назвать стоячую волну, образующуюся на колеблющейся струне. Для таких волн характерно движение, при котом максимумы «+» и минимумы «-»отклонения чередуются. Колебания на середине расстояния между максимумом и минимумом в любой момент времени отсутствуют.
 2018-01-21
2018-01-21 820
820








