Открыт А. Авогадро в 1811г.: в равных объемах различных газов при одинаковых условиях (давлении, температуры) содержится одинаковое число молекул.
Следствия из закона:
1)Массы одних и тех же объемов различных газов относятся друг к другу так, как относятся их молекулярные массы:

Закон Авогадро позволяет ввести величину относительной плотности одного газа от другого. Эта величина используется при решении задач, и она равна отношению масс двух газов, взятых в равных объемах при одинаковых количествах.

Плотность по водороду (DH2):
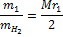
т.к. Mr (H2) = 2


Т.е. по этой формуле можно узнать молекулярную нужного вещества (следовательно, и молярную, т.к. они численно равны), зная его плотность по водороду.
Mr= Dвозд* 29
Dвозд – плотность по воздуху.
2)1 моль любого газа при нормальных условиях занимает объем 22,4л.
Нормальные условия:
o р (атм. давл.) = 101,3кПа = 101 325 Па
o t = 00С = 273 К.
Vm=22,4л – молярный объем
 2018-01-21
2018-01-21 2030
2030








