Электролитическая диссоциация, полный или частичный распад молекул растворенного вещества на катионы и анионы. Электролитической диссоциацией называют также распад на катионы и анионы ионных кристаллов при растворении или расплавлении.
Ионное произведение воды - произведение равновесных концентраций катионов водорода и гидроксид ионов, величина постоянная и равна 10-14 моль-ион/л.
[Н+]·[ОН-]=1·10-14 моль-ион/л (ионное произведение воды или константа автопротолиза).
Таким образом, ионное произведение воды позволяет для любого водного раствора найти концентрацию ОН- по известной концентрации Н+, и наоборот.
Водородный показатель рН - количественная характеристика кислотности среды, равная отрицательному десятичному логарифму концентрации свободных ионов водорода в растворе:
рН=-lg[Н+], рОН=-lg[ОН-], рН+рОН=14
В кислых растворах рН <7, в нейтральных =7, в щелочных >7.
Гидроксильный показатель рОН — это десятичный логарифм концентрации гидроксильных ионов, взятый с обратным знаком: рОН=— lg[OH~].
|
|
|
Степень диссоциации (а) электролита, как количественная характеристика равновесия процесса ионизации. Деление электролитов на сильные и слабые по величине степени диссоциации. Факторы, влияющие на степень диссоциации.
Степень диссоциации α - отношение числа молекул, распавшихся на ионы, к общему числу молекул
Степень диссоциации — величина, характеризующая состояние равновесия в реакции диссоциации в гомогенных (однородных) системах.
Степень диссоциации равна отношению продиссоциированных молекул вещества  к общему числу его молекул
к общему числу его молекул 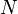 . Выражается в долях или процентах.
. Выражается в долях или процентах.

По степени диссоциации в растворах все электролиты делятся на две группы.
Сильные электролиты, электролиты, степень диссоциации которых в растворах α > 30 % и почти не зависит от концентрации раствора.
К сильным электролитам в водных растворах относятся щелочи: КОН, NaOH, Ba(OH)2, Са(ОН)2; кислоты: HNO3, НСl, H2SO4, НClO4, а также их соли.
Слабые электролиты, электролиты, степень диссоциации которых в растворах α< 2 % и уменьшается с ростом концентрации.
К ним относятся: слабые кислоты, в т.ч. органические (HCOOH, HNO2 и др.), нерастворимые основания и NH4OH, некоторые малорастворимые и нерастворимые соли.
(Между этими двумя группами нет четкой границы, одно и то же вещество в одном растворителе проявляет свойства сильного, а в другом - слабого электролита. Например, хлорид лития и иодид натрия, имеющие ионную кристаллическую решетку, при растворении в воде ведут себя как типичные сильные электролиты, при растворении же в ацетоне или уксусной кислоте эти вещества являются слабыми электролитами со степенью диссоциации в растворах меньше единицы.)
|
|
|
Степень диссоциации зависит:
1) от природы растворителя;
2) природы растворяемого вещества;
3) концентрации раствора (при разбавлении степень диссоциации a сильно возрастает);
4) температуры.
 2018-01-21
2018-01-21 5793
5793








