Химическая термодинамика – это раздел физической химии, изучающий взаимопревращение теплоты и энергии при протекании химической реакции.
Термодинамика основана на ряде понятий: система, состояние системы, параметры состояния системы, функции состояния системы, внутренняя энергия системы и т. д.
Термодинамическая система – это тело или группа тел, взаимодействующих между собой, и отделённых от окружающей среды реальной или воображаемой поверхностью раздела.
Состояние системы – это набор свойств системы, позволяющих описать систему с точки зрения термодинамики.
Физические свойства, характеризующие состояние системы, называют параметрами состояния системы
Взаимодействие системы с окружающей средой заметно по изменению параметров системы.
Экстенсивные параметры – это параметры, которые зависят от количества вещества системы и суммируются при объединении систем (объём, масса, энергия, площадь и т.д.).
Интенсивные параметры – это параметры, которые не зависят от количества вещества и выравниваются при объединении систем (температура, давление, концентрация, плотность, поверхностное натяжение).
|
|
|
Параметры состояния связаны уравнением состояния.
Уравне́ние состоя́ния — уравнение, связывающее между собой термодинамические (макроскопические) параметры системы, такие, как температура, давление, объём, химический потенциал и др.
Вдруг понадобится)):
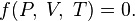
|
Таким образом, задать термическое уравнение состояния значит конкретизировать вид функции 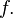
Переход системы из одного состояния в другое с изменением хотя бы одного параметра называется термодинамическим процессом.
Если процесс идет при постоянном давлении, он называется изобарным процессом. При постоянном объёме - изохорным, при постоянной температуре - изотермическим.
Функция состояния - это характеристика системы, которая не поддается прямому измерению, а рассчитывается через параметры состояния.
Значение функции состояния не зависит от способа его достижения, а только от начального и конечного состояния системы. Функции состояния: внутренняя энергия (U), энтальпия (H), энтропия (S), энергия Гиббса (G).
Внутренняя энергия - сумма всех видов энергий движения и взаимодействия частиц, составляющих систему.
Теплота - форма передачи энергии путем хаотического движения
микрочастиц.
Работа - форма передачи энергии путём направленного движения
макросистемы как целого.
 2018-01-21
2018-01-21 2025
2025
