1. Окисление спиртов.
а) Первичных
CH3OH + CuO 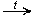 HCHO + Cu + H2O
HCHO + Cu + H2O
б) Вторичных
CH3—CH(OH)—CH3 + [O] 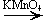 CH3—CO—CH3 + H2O
CH3—CO—CH3 + H2O
2. Дегидрирование спиртов.
а) Первичных
CH3CH2OH 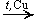 CH3CHO + H2
CH3CHO + H2
б) Вторичных
CH3—CH(OH)—CH3 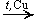 CH3—CO—CH3 + H2
CH3—CO—CH3 + H2
3. Окисление метана: CH4 + O2 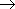 HCHO + H2O (При 500oС в присутствии оксидов азота)
HCHO + H2O (При 500oС в присутствии оксидов азота)
4. Гидратация ацетилена (реакция Кучерова; лабораторный способ): C2H2 + H2O  CH3CHO
CH3CHO
5. Окисление этилена: 2C2H4 + O2 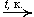 2CH3CHO
2CH3CHO
СУЛЬФОСОЕДИНЕНИЯ, органические соединения, содержащие остаток серной кислоты, т. н. сульфоксил или сульфогруппу, —S—ОН, лучаются сульфоны, содержащие группировку—S—, связанную с двумя радикалами. Обра- зование сульфокислот особенно легко идет в ароматических соединениях путем непосредственного действия крепкой серной к-ты на ароматические углеводороды но уравнению C0H0 + HO.SOa.OH -+ H20 + CeHs.S02-OH. Свободные сульфокислоты ароматического ряда представляют кристаллические тела, обыкновенно хорошо растворимые в воде, иногда расплывающиеся на воздухе. Благодаря легкости получения С. этого ряда и возможности замены сульфогруппы на иные группировки, С. получили большое применение в качестве промежуточных соединений в целом ряде хим. производств. Так напр. из С. могут быть получены фенолы при сплавлении С. со щелочами: C,H5-S0liONa+ NaOII -* CcH5OH + Ka.S03; действием на сульфокислоты пятихлористым фосфором получают гадоидоангидриды сульфокислот, из которых действием аммиака получают амиды сульфокислот или сульфамиды. Восстановлением С. получают тиофеполы. Замещение сульфогруппы на циан делает возможным превращение сульфокислот в карбо-новые к-ты. Введение сульфогруппы повышает растворимость в воде ароматических соединений и понижает их способность к окислению, что наблюдается при введении сульфогруппы в ароматические амины и фенолы. Из отдельных С. следует отметить: сульфо-бензод С„Н6803Н;сульфстолуол CH3.C0H4SO3H; судьфаниловая к-та, HSOs.C6H4.]SH2, служит исходным продуктом для получения азо-красок—метилоранжа, тропеодина и др., применяется для открытия азотистой к-ты при сан. исследованиях (реакция Грисса); к производным сульфокислоты нафтиламина относится красная краска конго, применяемая для открытия соляной к-ты в желудочном содержимом; о-сульфобензойная к-та CcH4(COOH)S03H, производным к-рой является сахарин (см.); суль-фосалициловая к-та СвН3(ОН) (СО.ОН) S03H находит применение в -качестве реактива на белок; /?-сульфо-а-аминопропионовая кислота, или цистеиновая HS03.CH2.CH(NH2).COOH получается окислением цистина, при декарбо-ксилировании переходит в сульфамин таурин NH2.CH2.CH2.S02H, принимающий участие в образовании желчных к-т; тиокол—калиевая соль сульфогваякола KS03.C6H3(OH)O.CH3; сульфонал (CH3)2C(S02C2H6)2 •— снотворный мед. препарат, так же как и трионал (С3Н5) (CH3).C(S02.C2H5)3 и тетронал (С2Н=)2 C(S03. С,На)а. Судьфоксилат формальдегида НО.СН2..S02Na—сильный восстановитель, входит в состав неосальварсана, новоарсола (см. Сальварсан). Введение сульфогруппы сильно понижает ядовитые свойства вещества. Так напр. введение в кольцо ядовитого анилина сульфогруппы ведет к образованию мало ядовитой сульфаниловой к-ты; тиокол значительно менее ядовит по сравнению с гваяколом. Понижение ядовитости стоит в тесной связи с уменьшением способности вещества окисляться после введения СуЛЬфОГруППЫ. А. Кузин.
.
| Тривиальное название | Название по ИЮПАК | Формула | Название солей |
| Муравьиная кислота | Метановая кислота | HCOOH | формиаты |
| Уксусная кислота | Этановая кислота | CH3COOH | ацетаты |
| Пропионовая кислота | Пропановая кислота | C2H5COOH | пропионаты |
| Масляная кислота | Бутановая кислота | C3H7COOH | бутираты |
| Валериановая кислота | Пентановая кислота | C4H9COOH | валераты |
| Капроновая кислота | Гексановая кислота | C5H11COOH | капраты |
| Энантовая кислота | Гептановая кислота | C6H13COOH | энантоаты |
| Каприловая кислота | Октановая кислота | C7H15COOH | каприлаты |
| Пеларгоновая кислота | Нонановая кислота | C8H17COOH | пеларогоаты |
| Каприновая кислота | Декановая кислота | C9H19COOH | капринаты |
| Ундециловая кислота | Ундекановая кислота | C10H21COOH | ундеканоаты |
| Лауриновая кислота | Додекановая кислота | C11H23COOH | лаураты |
| - | Тридекановая кислота | C12H25COOH | тридеканоаты |
| Миристиновая кислота | Тетрадекановая кислота | C13H27COOH | миристиаты |
| - | Пентадекановая кислота | C14H29COOH | пентадеканоаты |
| Пальмитиновая кислота | Гексадекановая кислота | C15H31COOH | пальмитаты |
| Маргариновая кислота | Гептадекановая кислота | C16H33COOH | маргараты |
| Стеариновая кислота | Октадекановая кислота | C17H35COOH | стеараты |
| - | Нонадекановая кислота | C18H37COOH | нонадеканоаты |
| Арахиновая кислота | Эйкозановая кислота | C19H39COOH | арахаты |
| - | Генэйкозановая кислота | C20H41COOH | генэйкозаноаты |
| Бегеновая кислота | Докозановая кислота | C21H43COOH | бегенаты |
| - | Трикозановая кислота | C22H45COOH | трикозаноаты |
| Лигноцериновая кислота | Тетракозановая кислота | C23H47COOH | лигноцераты |
| - | Пентакозановая кислота | C24H49COOH | пентакозаноаты |
| Церотиновая кислота | Гексакозановая кислота | C25H51COOH | церотитаты |
| - | Гептакозановая кислота | C26H53COOH | гептакозаноаты |
| Монтановая кислота | Октакозановая кислота | C27H55COOH | монтаноаты |
| - | Нонакозановая кислота | C28H57COOH | нонакозаноаты |
| Мелиссовая кислота | Триаконтановая кислота | C29H59COOH | мелиссаты |
| - | Гентриаконтановая кислота | C30H61COOH | гентриаконтаноаты |
| - | Дотриаконтановая кислота | C31H63COOH | дотриаконтаноаты |
| Псилластеариновая кислота | Тритриаконтановая кислота | C32H65COOH | псилластеарилаты |
Билет № 13
1. Карбоновые кислоты жирного ряда. Гомологический ряд одноосновных карбоновых кислот, номенклатура (историческая, рациональная и систематическая). Получение, химические свойства. Производные карбоновых кислот, их ацилирующая активность.
Карбо́новыекисло́ты — класс органических соединений, молекулы которых содержат одну или несколько функциональных карбоксильных групп -COOH. Кислые свойства объясняются тем, что данная группа может сравнительно легко отщеплять протон. За редкими исключениями карбоновые кислоты являются слабыми. Например, у уксусной кислоты CH3COOH константа кислотности равна 1,75·10−5. Ди- и трикарбоновые кислоты более сильные, чем монокарбоновые.
По международной номенклатуре ИЮПАК, карбоновые кислоты называют, выбирая за основу наиболее длинную углеродную цепочку, содержащую группу -СООН, и добавляя к названию соответствующего углеводорода окончание «овая» и слово «кислота». При этом атому углерода, входящему в состав карбоксильной группы, присваивается первый номер. Например СН3-СН2-СООН — пропановая кислота, СН3-С(СН3)2-СООН — 2,2-диметилпропановая кислота.
По рациональной номенклатуре к названию углеводорода добавляют окончание «карбоновая» и слово «кислота», не включая при этом в нумерацию цепи атом углерода карбоксильной группы. Например, С5Н9СООН — циклопентанкарбоновая кислота, СН3-С(СН3)2-СООН — трет-бутилкарбоновая кислота.
Многие из карбоновых кислот имеют тривиальные названия (некоторые из них приведены в таблице).
| Тривиальное название | Название по ИЮПАК | Формула | Название солей |
| Щавелевая кислота | Этандиовая кислота | HOOCCOOH | оксалаты |
| Малоновая кислота | Пропандиовая кислота | HOOCCH2COOH | малонаты |
| Янтарная кислота | Бутандиовая кислота | HOOC(СH2)2COOH | сукцинаты |
| Глутаровая кислота | Пентандиовая кислота | HOOC(СH2)3COOH | глутараты |
| Адипиновая кислота | Гександиовая кислота | HOOC(СH2)4COOH | адипинаты |
| Пимелиновая кислота | Гептандиовая кислота | HOOC(СH2)5COOH | пимелинаты |
| Пробковая кислота | Октандиовая кислота | HOOC(СH2)6COOH | субераты |
| Азелаиновая кислота | Нонандиовая кислота | HOOC(СH2)7COOH | азелаинаты |
| Себациновая кислота | Декандиовая кислота | HOOC(СH2)8COOH | себацинаты |
| - | Ундекандиовая кислота | HOOC(СH2)9COOH | |
| - | Додекандиовая кислота | HOOC(СH2)10COOH | |
| Брассиловая кислота | Тридекандиовая кислота | HOOC(СH2)11COOH | |
| - | Тетрадекандиовая кислота | HOOC(СH2)12COOH | |
| - | Пентадекандиовая кислота | HOOC(СH2)13COOH | |
| Тапсиевая кислота | Гексадекандиовая кислота | HOOC(СH2)14COOH | |
| - | Гептадекандиовая кислота | HOOC(СH2)15COOH | |
| - | Октадекандиовая кислота | HOOC(СH2)16COOH | |
| - | Нонадекандиовая кислота | HOOC(СH2)17COOH | |
| - | Эйкозандиовая кислота | HOOC(СH2)18COOH | |
| Японовая кислота | Генэйкозандиовая кислота | HOOC(СH2)19COOH |
 2018-01-21
2018-01-21 407
407








