Общая, неорганическая и физическая химия.
Щелочные металлы – способы получения, химические свойства, применение. Гидриды – получение, химические свойства, применение.
Щелочны́е мета́ллы — элементы главной подгруппы I группы Периодической системы химических элементов Д. И. Менделеева: литий Li, натрий Na, калий K, рубидий Rb, цезий Cs и франций Fr. Эти металлы получили название щелочных, потому что большинство их соединений растворимо в воде. При растворении щелочных металлов в воде образуются растворимые гидроксиды, называемые щёлочами.
Особенность строения атомов щелочных металлов заключается в том, что они содержат один электрон на новом энергетическом уровне: их электронная конфигурация ns1. Для всех щелочных металлов характерны восстановительные свойства.
Все металлы этой подгруппы имеют серебристо-белый цвет (кроме серебристо-жёлтого цезия), они очень мягкие, их можно резать скальпелем. Литий, натрий и калий легче воды и плавают на её поверхности, реагируя с ней.
Для получения щелочных металлов используют в основном электролиз расплавов их галогенидов, чащевсего — хлоридов, образующих природные минералы
Химические свойства щелочных металлов.
Из-за высокой химической активности щелочных металлов по отношению к воде, кислороду, азоту их хранят под слоем керосина. Чтобы провести реакцию со щелочным металлом, кусочек нужного размера аккуратно отрезают скальпелем под слоем керосина, в атмосфере аргона тщательно очищают поверхность металла от продуктов его взаимодействия с воздухом и только потом помещают образец в реакционный сосуд.
Оксиды щелочных металлов обладают всеми свойствами, присущими основным оксидам: они реагируют с водой, кислотными оксидами и кислотами.
Щелочные металлы реагируют со многими неметаллами. При нагревании они соединяются с водородом с образованием гидридов.
Щелочные металлы растворяются в жидком аммиаке и его производных.
Литий служит сырьем в атомной энергетике, используется в ракетной технике. В металлургии применяется для удаления остатков водорода, азота, кислорода, серы. Натрий необходим для атомной энергетики, металлургии, органического синтеза. Цезий и рубидий используются при изготовлении фотоэлементов.
Гидриды — соединения водорода с металлами и с имеющими меньшую электроотрицательность, чем водород, неметаллами.
Гидриды металлов – обладают только сильными восстановительными свойствами.
Химические свойства:
· Взаимодействие ионных гидридов с водой:
· Взаимодействие с оксидами металлов:
· Термическое разложение:
· Взаимодействие с азотом:
Ионные гидриды получают взаимодействием простых веществ:
2Na + H2 → 2NaH
Гидриды широко применяются для проведения различных синтезов, для получения водорода и в химическом анализе. Гидрид кальция используется в качестве осушителя для удаления следов влаги.
Гидрид натрия 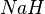 применяют для очистки железа от магнетита.
применяют для очистки железа от магнетита.
 2018-01-21
2018-01-21 1696
1696