· При производстве маргарина из жидких растительных масел.
· Зарегистрирован в качестве пищевой добавки E949.
Топливо
Водород используют в качестве ракетного топлива.
Ведутся исследования по применению водорода как топлива для легковых и грузовых автомобилей.
Электроэнергетика
Водород применяется для охлаждения мощных электрических генераторов.
46. Фтор, хром, бром, йод. Получение, физические и химические свойства, изменение окислительной активности (в подгруппе). Взаимодействие галогенов с водой и растворами щелочей.
Галоге́ны — химические элементы 17-й группы периодической таблицы химических элементов Д. И. Менделеева (фтор F, хлор Cl, бром Br, иод I).
Реагируют почти со всеми простыми веществами, кроме некоторых неметаллов. Все галогены — энергичные окислители, поэтому встречаются в природе только в виде соединений.
Имея на внешней электронной оболочке 7 электронов, атомы всех галогенов легко присоединяют недостающий до завершения оболочки 1 электрон и в своих соединениях проявляют степень окисления −1. Хлор, бром, иод в соединениях с более электроотрицательными элементами проявляют положительные степени окисления: +1, +3, +5. Для фтора характерна постоянная степень окисления −1.
Физические свойства.
| Вещество | Агрегатное состояние при обычных условиях | Цвет | Запах |
| Фтор F2 | Газ, не сжижается при обычной температуре | Светло-желтый | Резкий, раздражающий |
| Хлор CI2 | Газ, сжижающийся при обычной температуре под давлением | Жёлто-зелёный | Резкий, удушливый |
| Бром Br2 | Жидкость | Буровато-коричневый | Резкий, зловонный |
| Йод I2 | Твёрдое вещество | Тёмно-серый с металлическим блеском | Резкий |
Фтор
Самый активный неметалл, бурно взаимодействует почти со всеми веществами. Ко фтору при комнатной температуре устойчивы некоторые металлы за счёт образования плотной плёнки фторида, тормозящей реакцию со фтором — Al, Mg, Cu, Ni. Контакт фтора с водородом приводит к воспламенению и взрыву даже при очень низких температурах (до −252°C). В атмосфере фтора горят даже вода и платина.
Получение:
1) Добыча и обогащение флюоритовых руд, сернокислотное разложение их концентрата с образованием безводного HF и его электролитическое разложение.
2) Электролизом расплава кислого фторида калия KF·2HF, который образуется при насыщении расплава KF фтористым водородом до содержания 40—41 % HF. Процесс электролиза проводят при температурах около 100 °C в стальных электролизёрах со стальным катодом и угольным анодом.
Хлор
Хлор непосредственно реагирует почти со всеми металлами.
C большинством неметаллов, образует соответствующие хлориды.
На свету или при нагревании активно реагирует (иногда со взрывом) с водородом.
Хлор может таким же образом реагировать (диспропорционировать) со щелочами:
С кислородом хлор образует оксиды, в которых он проявляет степень окисления от +1 до +7. Они имеют резкий запах, термически и фотохимически нестабильны, склонны к взрывному распаду.
Получение:
Получения хлора каталитическим окислением хлороводорода кислородом воздуха. Используется при рекуперации хлора из хлороводорода, являющегося побочным продуктом при промышленном хлорировании органических соединений.
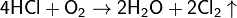
Хлор можно получить действием кислоты на гипохлорит натрия:
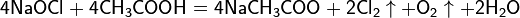
Бром
В свободном виде существует в виде двухатомных молекул Br2.
Бром немного, но лучше других галогенов растворим в воде, раствор называют бромной водой. В бромной воде протекает реакция с образованием бромоводородной и неустойчивой бромноватистой кислот:
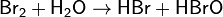
По химической активности бром занимает промежуточное положение между хлором и иодом. При реакции брома с растворами иодидов выделяется свободный иод:
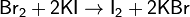
Напротив, при действии хлора на бромиды, находящиеся в водных растворах, выделяется свободный бром:
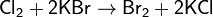
Реакция брома с водородом протекает при нагревании и приводит к образованию бромоводорода HBr. Раствор HBr в воде — это бромоводородная кислота, по силе близкая к соляной кислоте HCl.
Бром — сильный окислитель, он окисляет сульфит-ион до сульфата, нитрит-ион — до нитрата. При взаимодействии брома с растворами щелочей и с растворами карбонатов натрия или калия образуются соответствующие бромиды и броматы.
Бром получают химическим путём из рассола Br−:
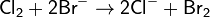
Йод
Химически йод довольно активен, но в меньшей степени, чем хлор и бром.
С металлами йод при легком нагревании энергично взаимодействует, образуя йодиды:
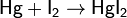
С водородом йод реагирует только при нагревании и не полностью, образуя йодоводород:
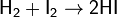
Йод является окислителем, менее сильным, чем фтор, хлор и бром. Сероводород H2S, Na2S2O3 и другие восстановители восстанавливают его до ионаI−:
При растворении в воде йод частично реагирует с ней:
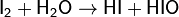
 2018-01-21
2018-01-21 793
793








