Для реальных газов теплоемкости cV и сP зависят от давления и температуры газа. Это обусловлено наличием сил межмолекулярного взаимодействия, изменением взаимного положения атомов в молекулах (молекулы двух и многоатомных газов не жесткие, присутствует колебательное движение атомов в молекуле) и неравномерным распределением внутренней энергии по степеням свободы в зависимости от изменения температуры и давления газа.
Зависимость теплоемкости газов от давления в большей степени проявляется в состоянии газов, близком к области насыщения, об этом будет сказано в разделе "Реальные газы и пары". Для газов, состояние которых далеко от области насыщения, зависимость теплоемкости от давления незначительна и при практических расчетах ею пренебрегают. Зависимость от температуры очень существенна, ей пренебрегать при точных расчетах нельзя.
Аналитическое выражение этой зависимости весьма сложное и требует нахождения целого ряда экспериментальных констант для каждого газа. Практическое определение теплоемкостей сV и сPреальных газов ведется экспериментально. В соответствии с этим были введены понятия истинной и средней теплоемкости газа.
Истинная теплоемкость газа соответствует расчетному выражению
 | (4.35) |
Она определяется как частное от деления элементарной теплоты процесса на элементарное изменение его температуры относительно точки процесса с фиксированной температурой (рис.4.2). Для реальных газов каждому значению температуры процесса соответствует вполне определенное значение истинной теплоемкости.
Экспериментальная зависимость истинной теплоемкости процесса реального газа от температуры обычно представляется в виде степенного полинома графика (рис.4.2), или табличного численного материала.
 | (4.36) |
Определение теплоты с помощью истинной теплоемкости ведется интегрированием
 | (4.37) |
Теплота q12 на рис.4.3 соответствует площади под процессом 12.
Средняя теплоемкость газа соответствует расчетному выражению
 | (4.38) |
она определяется как теплота процесса, идущего в интервале температур t1 и t2, деленная на разность этих температур (рис.4.3).
Средней теплоемкостью можно пользоваться только на данном интервале температур. Это очень неудобно, т.к. для практических расчетов необходимо в таблицах экспериментальных данных по средним теплоемкостям предусмотреть все возможные температурные интервалы. Выход из этой ситуации был найден введением средней теплоемкости, определенной от одинаковой начальной температуры. В качестве такой температуры приняли 0 OС. Расчетное выражение средней теплоемкости, определенной от 0 OС, имеет вид
 | (4.39) |
Используя эту теплоемкость, можно определить теплоту и среднюю теплоемкость в любом интервале температур процесса (рис.4.3). Площадь под процессом А1соответсвует теплоте q01=cm01t1, а под процессом А2 - теплоте q02=cm02t2, теплота процесса 12 определяется как разность этих площадей
 | (4.40) |
Следовательно, средняя теплоемкость на интервале температур t1 и t2 будет определяться как
 | (4.41) |
В справочных таблицах свойств газов даются значения истинных теплоемкостей при конкретных температурах и средних теплоемкостей в интервале от 0 OС до t.
Экспериментально проще определяются изобарные теплоемкости газов. Изохорные теплоемкости газов, подчиняющихся уравнению Pv=RT, расчитывают по формуле Майера cV =cP-R. Удельные мольные и объемные теплоемкости реальных газов расчитываются по их соотношениям с удельными массовыми теплоемкостями.
Истинная и средняя теплоемкости
Теплоемкость является функцией параметров состояния – давления и температуры, поэтому в технической термодинамике различают истинную и среднюю теплоемкости.
Теплоемкость идеального газа зависит только от температуры и по определению может быть найдена лишь в интервале температур  . Однако всегда можно предположить, что этот интервал очень мал вблизи какого-либо значения температуры. Тогда можно сказать, что теплоемкость определена при данной температуре. Такая теплоемкость называется истинной.
. Однако всегда можно предположить, что этот интервал очень мал вблизи какого-либо значения температуры. Тогда можно сказать, что теплоемкость определена при данной температуре. Такая теплоемкость называется истинной.
В справочной литературе зависимость истинных теплоемкостей ср и сv от температуры задают в виде таблиц и аналитических зависимостей. Аналитическую зависимость (например, для массовой теплоемкости) обычно представляют в виде полинома:

Тогда количество подведенной в процессе теплоты в интервале температур [ t1,t2 ] определяется интегралом:
 . (2)
. (2)
При исследовании термодинамических процессов часто определяют среднее в интервале температур значение теплоемкости. Она представляет собой отношение количества подведенной в процессе теплоты Q12 к конечной разности температур:
 . (3)
. (3)
Тогда, если задана зависимость истинной теплоемкости от температуры, в соответствии с (2):
 .
.
Часто в справочной литературе приводят значения средних теплоемкостей ср и сv для интервала температур от 0 до tоС. Как и истинные, их представляют в виде таблиц и функций:
 (4)
(4)
При подстановке значения температуры t в эту формулу будет найдена средняя теплоемкость в интервале температур [ 0,t ]. Чтобы найти среднее значение теплоемкости в произвольном интервале [ t1,t2 ], пользуясь зависимостью (4), нужно найти количество теплоты Q12, подведенной к системе в этом интервале температур. На основании известного из математики правила интеграл в уравнении (2) может быть разбит на следующие интегралы:
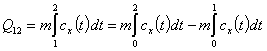 .
.
Но
 , а
, а  .
.
Тогда
 .
.
После этого искомое значение средней теплоемкости находят по формуле (3).
Газовые смеси
В технике в качестве рабочих тел чаще используются не чистые вещества, а смеси различных газов. Под газовой смесью в данном случае понимают механическую смесь чистых веществ, называемых компонентами смеси, не вступающих друг с другом в химические реакции. Примером газовой смеси является воздух, основными компоненты которого являются кислород и азот. Если компонентами смеси являются идеальные газы, то и смесь в целом также будем считать идеальным газом.
Теплоемкость газа.
Виды теплоемкости.
Теплоемкостью называют количество теплоты, которое необходимо сообщить телу для того, чтобы в данном процессе изменить его температуру на 1о С.
В тепловых расчетах применяются следующие виды теплоемкостей:
I В зависимости от количественной единицы газа - мольная теплоемкость отнесенная к 1 кмолю; массовая, отнесенная к 1 кг и объемная - отнесенная к 1 м2μ (при н.ф.у.).
II В зависимости от процесса изменения состояния газа наиболее часто применяются:
-изобарная теплоемкость - при p=const
-изохорная - при V=const
III В зависимости от интервалов температуры, в которой подводится или отводится теплота, различают среднюю теплоемкость - в конечном интервале температур, и истинную теплоемкость (в бесконечно малом интервале температур)
Наглядное представление о перечисленных видах теплоемкостей.
Мольная Массовая Объемная
μС [кДж/кмоль*К] С [кДж/кг*К] С' [кДж/М3н*К]
изобарная изохорная изобарная изохорная изобарная изохорная
µCр µCv Cр Cv Cр' Cv'
ист. средн. ист. средн. ист. средн. ист. средн. ист. средн. ист. средн.
µCр µCрm µCv µCvm Cр Cрm Cv Cvm Cр' Cрm' Cv' Cvm'
 2017-12-14
2017-12-14 3853
3853
