Материалы и оборудование: различные органические кислоты (водные растворы, см. предыдущий опыт), индикаторные бумажки конго (фильтровальная бумага, 1%-ный раствор конго красного), глицерин (10%-ный водный раствор), разбавленная серная кислота, стеклянные палочки.
Для приготовления индикаторных бумажек пропитывают фильтровальную бумагу 1%-ным водным раствором конго красного (азокраситель, получающийся при сочетании диазотированного бензидина с нафтионовой кислотой), высушивают и нарезают полосками.
ХОД ОПЫТА
Испытывают действие на бумажку конго водных растворов различных кислот примерно одинаковой концентрации (полученных в предыдущем опыте). Для этого проводят по сухой бумажке черту чистой тонкой палочкой, смоченной соответствующим раствором; получаются полоски различного цвета и разной интенсивности окраски.
Для сравнения испытывают таким же образом воду, растворы глицерина и разбавленную соляную кислоту.
При действии слабых кислот бумажка конго окрашивается в коричнево-черный цвет, который затем бледнеет; при действии более сильных кислот – в синевато-черный, а при действии самых сильных – в устойчивый синий цвет.
Степень диссоциации слабой кислоты в разбавленном водном растворе определяется ее константой ионизации К и концентрацией раствора кислоты С (в грамм-эквивалентах на литр). Зная величины К и С, можно приближенно подсчитать как степень диссоциации кислоты α (в %) в данном растворе, так и концентрацию в нем ионов водорода [Н+] (в молях на литр). Для слабых электролитов, какими являются большинство органических кислот, эти величины вычисляют по следующим формулам, выводимым из закона действия масс:
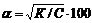
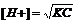
Для сильных кислот (серной, соляной, трихлоруксусной и т.п.) эти формулы неприменимы.
Константы ионизации органических кислот, характеризующие их относительную «силу», весьма различны и в большой степени зависят от состава и строения молекулы кислоты.
Уксусная кислота и ее последующие гомологи имеют константы ионизации порядка 1∙10-5 - 2∙10-5, т.е. являются весьма слабыми кислотами; муравьиная кислота значительнее сильнее. Щавелевая кислота сильнее диссоциирована, чем, многие минеральные кислоты.
Различия в «силе» - степени ионизации карбоновых кислот обусловлены влиянием заместителей, расположенных достаточно близко к карбоксильной группе, точнее, их индуктивными эффектами (I). По сравнению с атомом водорода при углероде следующие замещающие его электрофильные группы обнаруживают - I -эффект, т.е. оттягивают к себе электронные пары близких С-атомов: (Н)< ОН < Br < Cl < COOR < CO < NO2.
Этот ряд построен по все возрастающей величине I -эффекта. Эффект передается далее по связям цепи С-атомов до карбоксильной группы и протон последней ионизируется тем легче, чем сильнее - I -эффект заместителя. Углеводородные радикалы дают противоположный, + I -эффект (также по сравнению с атомом водорода), т.е. отталкивают электронную пару соседнего С-атома, и при их наличии сила кислоты несколько снижается.
Таблица 1. Степень ионизации кислот
| Название | Формула | Константа ионизации К1 | Концентрация ионов водорода в 0,1 М водном растворе (С=0,1) | |
| абсолютная, моль/л | Относительная ([H+] для уксусной кислоты равна 1) | |||
| Вода | НОН | 1,8∙10-16 | 1∙10-7 | 0,00007 |
| Глицерин | С2Н5(ОН)3 | 7∙10-15 | 1,3∙10-7 | 0,0001 |
| Фенол | С6Н5ОН | 1,3∙10-10 | 3,6∙10-6 | 0,003 |
| Кислоты | ||||
| Муравьиная | НСООН | 1,8∙10-4 | 4,25∙10-3 | 3,2 |
| Уксусная | СН3COOH | 1,8∙10-5 | 1,34∙10-3 | |
| Масляная | CH3CH2CH2COOH | 1,5∙10-5 | 1,22∙10-3 | 0,9 |
| Хлоруксусная | CH2ClCOOH | 1,6∙10-3 | 1,26∙10-2 | 9,4 |
| Трихлоруксусная | CCl3COOH | 1,3∙10-1 | 1∙10-1 | 75 |
| Угольная (считая на растворенный СО) | OH CO OH | 4∙10-7 | 2∙10-4 | 0,15 |
| Щавелевая | HOOC-COOH | 5∙10-2 | 7∙10-2 | 50 |
| .Янтарная | НООС-(СН2)2-COOH | 6,6∙10-5 | 2,6∙10-3 | |
| Малеиновая | CHCOOH CHCOOH | 1∙10-2 | 3,2∙10-2 | |
| Фумаровая | CHCOOH HOOCCH | 1∙10-3 | 1∙10-2 | 7,5 |
| Гликолевая | CH2(OH)COOH | 1,5∙10-4 | 3,9∙10-3 | 2,9 |
| Молочная | CH3CH(OH)COOH | 1,4∙10-4 | 3,7∙10-3 | 2,8 |
| Винная | CH(OH)COOH CH(OH)COOH | 1∙10-3 | 1∙10-2 | 7,5 |
| Фосфорная | H3PO4 | 8∙10-3 | 2,8∙10-2 | |
| Соляная | HCl | - | 1∙10-1 | 75 |
Индуктивный эффект быстро затухает по цепи ординарных С-С связей. Большую степень ионизации муравьиной кислоты по сравнению с уксусной приписывают не только +I-эффекту СН3-группы, но и различиям в сольватации этих двух кислот в растворах.
В таблице 1 приведены константы ионизации некоторых веществ. Для многоосновных кислот приводится лишь константа ионизации К1 первой карбоксильной группы; вторая и последующие карбоксильные группы ионизируются значительно слабее. В последних столбцах табл. 1 сравниваются концентрации ионов водорода в 0,1 М водных растворах различных кислот, как абсолютные, так и относительные, по сравнению с условно принятой за единицу концентрацией ионов водорода в растворе уксусной кислоты; эти цифры более наглядно показывают относительную силу кислот в подобных растворах.
Интервал перехода окраски индикатора конго в единицах водородного показателя находится в пределах рН 3,0 (синий цвет) – 5,0 (красный цвет), т.е. в пределах концентрации ионов водорода [H+] от 1∙10-3 до 1∙10-5.
Индикаторные бумажки для определения рН обычно показывают эту величину с точностью лишь до двух единиц шкалы рН и поэтому при их применении в опыте 2 получается менее четкая картина, чем с бумажкой конго.
Кислую реакцию по различным индикаторам в водном или водно-спиртовом растворе обнаруживают кроме карбоновых кислот сульфокислоты, а также соли многих аминов, некоторые легко гидролизующиеся ангидриды, сложные эфиры и некоторые фенолы и нитрофенолы.
 2018-01-21
2018-01-21 2111
2111








