Добавление общего иона уменьшает диссоциацию слабого электролита. Так, при добавлении к раствору слабого электролита CH3COOH
CH3COOH 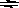 CH3COO- + H+ a<<1
CH3COO- + H+ a<<1
сильного электролита, содержащего общий с CH3COOH ион, то есть ацетат-ион, например, CH3COONa
CH3COONa 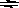 CH3COO- + Na+ a = 1
CH3COO- + Na+ a = 1
концентрация ацетат иона увеличивается, и равновесие диссоциации CH3COOH сдвигается влево, то есть диссоциация уменьшается.
б) Расчет равновесных концентраций ионов в растворах слабых многоосновных кислот.
Многоосновные кислоты и многокислотные основания диссоциируют ступенчато и каждая ступень диссоциации характеризуется ступенчатой константой. Разница в ступенчатых константах диссоциации обычно составляет несколько порядков, поэтому для расчета концентрации ионов можно ограничиться учетом диссоциации по первой ступени.
Пример. Вычислить рН 0,1 М водного раствора этилендиамина.
Решение:
Этилендиамин является двукислотным основанием:
H2NCH2=CH2NH2 + H2O ⇄H2NCH2=CH2NH3+ + OH- Kb1=1,2.10-4
H2NCH2=CH2NH3+ + H2O ⇄ (H3NCH2=CH2NH3)2+ + OH- Kb2=9,8.10-8
Kb1>>Kb2,
поэтому диссоциацию этилендиамина можно рассматривать только по первой ступени.
H2NCH2=CH2NH2 + H2O⇄ H2NCH2=CH2NH3+ + OH- Kb1=1,2.10-4
С0 0,1
[ ] 0,1 – x x x
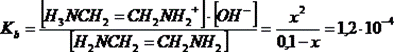
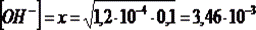
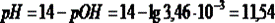
Многоосновные кислоты и многокислотные основания в зависимости от рН раствора могут существовать в виде недиссоциированных молекул, а также в виде различных ионов. Например, фосфорная кислота (H3PO4) в водном растворе может находиться в виде H3PO4, H2PO4-, HPO42-, PO43-. В зависимости от рН, какая-то из форм может преобладать в растворе. Определение концентраций удобно проводить через расчет мольных долей для каждой из форм:
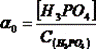 ,
, 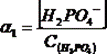 ,
, 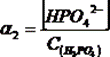 ,
, 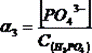 ,
,
где 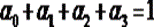 .
.
Пример. Построить зависимость концентрации всех форм, образующихся при диссоциации фосфорной кислоты, от рН раствора.
Решение:
Выразим 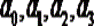 через [H3O+] (или [H+]), K1, K2, K3.
через [H3O+] (или [H+]), K1, K2, K3.
H3PO4 ⇄ H2PO4- + H+ 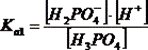
H2PO4- ⇄ HPO42- + H+ 
HPO42- ⇄ PO43- + H+ 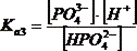
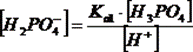 ,
, 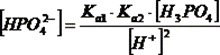 ,
,
 .
.
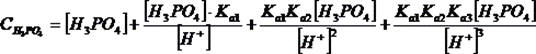
Мольная доля – это отношение концентрации частицы данного вида к суммарной концентрации всех частиц:

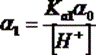
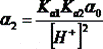
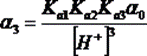
13. Мышьяк, сурьма, висмут. Электронная конфигурация атомов в основном и валентно- возбуждённом состояниях, степени окисления. Взаимодействие с концентрированны- ми азотной и серной кислотами; галогенами. Характер образующихся соединений.
Мышьяк (As)
В основном состоянии: [Ar] 4s2 3d10 4p3
В возбужденном: [Ar] 4s1 3d10 4p3 4d1
СО: +5;+3;-3; 0
Структура: существует в нескольких аллотропических формах, из которых наиболее устойчив серый (металлический) мышьяк с ромбоэдрической кристаллической решеткой; При очень быстрой конденсации паров мышьяка на поверхности, охлаждаемой жидким N2, получают прозрачные, мягкие как воск кристаллы желтого мышьяка. При нагревании и под действием ультрафиолета желтый мышьяк быстро переходит в серый с выделением тепла. При конденсации паров мышьяка в инертной атмосфере образуется еще одна аморфная форма этого элемента черного цвета. Если пары мышьяка осаждать на стекле, образуется зеркальная пленка.
Получение: Мышъяксодержащие руды подвергают обжигу и извлекают мышьяк в виде As2O3. Его возгоняют и получают продукт с чистотой более 98%. Металлический мышьяк также получают из As2O3 восстановлением его углеродсодержащими восстановителями (чаще всего древесным углем). Очищают мышьяк сублимацией.
2As2S3+9O2→(t)6SO2+2As2O3
As2O3+3C→(t)2As+3CO
Применение: Элементарный мышьяк находит ограниченное применение в виде добавок к сплавам (на основе Сu, Рb и Sn) и полупроводниковым материалам. Мышьяк особой чистоты используют для синтеза важнейших полупроводниковых материалов.
AsCl3+NACL=NA[AsCl4]
Химические свойства:
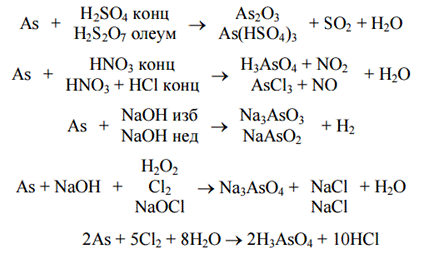
Сурьма (Sb)
В основном состоянии: [Kr] 5s2 4d10 5p3
В возбужденном: [Kr] 5s1 4d10 5p3 5d1
СО: +5;+3;-3; 0
Структура, физические свойства: блестящий хрупкий металл с голубым оттенком; желтая сурьма – образуется конденсацией паров до низких температур при быстром охлаждении; взрывчатая сурьма – получается электролизом хлоридных растворов (SbCl3 + HCl) на катоде, содержит следы хлора.
Получение:
1)Обжиг оксидных и сульфидных руд.
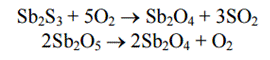
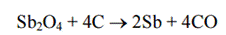
Sb2S3+3Fe=2Sb+3FeS
2)
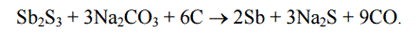
3)
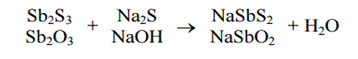
Электролиз
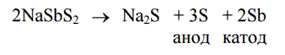
Применение: Сурьма-компонент сплавов на основе Рb и Sn (для аккумуляторных пластин, типографских шрифтов, подшипников и др.), на основе Си и Zn, Sn. Чистую сурьму используют для получения антимонидов с полупроводниковыми свойствами.
Химические свойства:
2Sb+3Cl2=2SbCl3
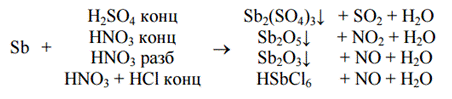
Висмут (Bi)
В основном состоянии: [Xe] 4f14 5d10 6s2 6p3
В возбужденном: [Xe] 4f14 5d10 6s1 6p3 6d1
СО: +5;+3;-3; 0
Физические свойства: серый металл с красноватым оттенком, легкоплавок (271).
Получение:
1)
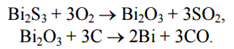
2)
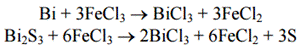
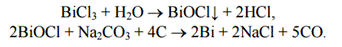
Применение: Металлический висмут - компонент легкоплавких сплавов, припоев и др., присадка к легко обрабатываемым сталям, др. сплавам, алюминию. Сплавы висмута с Мn применяют для изготовления мощных постоянных магнитов.
Bi2O3+6NAOH+2BR2=2NABIO3+4NABR+3H2O
Bi2O3+2NA2O2=2NABIO3+NA2O
BiCl3+h2o=BIOCL+2HCL
Химические свойства:
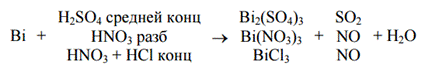
14. Сернистая кислота, её кислотные свойства. Окислительно-восстановительные свойства сернистой кислоты и сульфитов. Равновесия в растворах гидросульфитов и сульфитов. Сульфит-ион как лиганд.
Гидролиз сульфитов
Водные растворы сульфитов вследствие гидролиза имеют щелочную среду (окрашивают лакмус в синий цвет).
SO3-+ Н2O = HSO3-+ ОН-
Na2SO3 + Н2O = NaHSO3 + NaOH
 2018-01-21
2018-01-21 1403
1403








