I. Сульфиты как восстановители.
Сульфиты, подобно SO2, могут быть и восстановителями, и окислителями, поскольку атомы серы в анионах SO3 находятся в промежуточной С.О. +4
В водных растворах и сульфиты, и гидросульфиты легко окисляются до сульфатов. Примеры реакций:
Na2SO3 + Вr2 + Н2O = Na2SO4 + 2НВr
5K2SO3 + 2КМпO4 + 3H2SO4 = 6K2SO4 + 2MnSO4 + 3Н2O
Даже твердые сульфиты при хранении на воздухе медленно окисляются до сульфатов:
2Na2SO3 + O2 = 2Na2SO4
II. Сульфиты как окислители.
Эти реакции не столь многочисленны. При нагревании сухих сульфитов с такими активными восстановителями, как С, Mg, Al, Zn, они переходят в сульфиды:
Na2SO3 + ЗС = Na2S + ЗСО
III. Диспропорционирование сухих сульфитов.
При нагревании до высоких температур сульфиты медленно превращаются в смесь сульфатов и сульфидов:
4K2SO3 = 3K2SO4 + K2S
Сернистая кислота — неустойчивая двухосновная неорганическая кислота средней силы. Отвечает степени окисления серы +4. Химическая формула H2SO3, существует лишь в водных растворах.тк Кгидр=Kw/Ka1=5*10(-13)<Ka2=6,2*10(-8)=> среда р-ра гидросульфита-кислая.
В водном растворе устанавливаются равновесия:
При хранении раствора кислоты необходимо исключить доступ воздуха. Иначе сернистая кислота, медленно поглощая кислород (O2), превратится в серную.
2H2SO3 (кислота сернистая) + O2 (кислород) = 2H2SO4 (кислота серная)
Растворы сернистой кислоты имеют довольно специфический запах (напоминает запах, остающийся после зажжения спички), наличие которого можно объяснить присутствием оксида серы (SO2), химически не связанного водой.
Двухосновная кислота, образует два ряда солей: кислые — гидросульфиты (в недостатке щёлочи):H2SO3 + NaOH = H2O + NaHSO3
и средние — сульфиты (в избытке щёлочи):H2SO3 + 2NaOH = H2O + Na2SO3
2NaHO3=NA2S2O5+H2O
NA2SO3+S=NA2S2O3
2NASO3+O2=2NA2SO4
H2SO3+2H2S=3S+3H2O
Хорошо растворимы в воде средние соли щелочных металлов и аммония, при этом они гидролизуются с подщелачиванием раствора:
В водных растворах кислых солей одновременно протекают два обратимых процесса-гидролиз и диссоциация гидросульфит-иона:
Сопоставив конствнты гидролиза и диссоциации гидросульфит-иона, можно сделать вывод, что среда в водных растворах гидросульфитов-кислая.
Геометрическая конфигурация SO3(2-)-иона-тригональная пирамида:
Пространственное расположение орбитали с неподел электронной парой(sp3) определяет высокую донорную способность иона и активное его участие в обменных овр.
Сульфит-ион способен координироваться к ионам металлов как через атом серы, так и атомы кислорода с образованием сульфитных комплексов, например,.
В последнем соединении ион занимает два коорд места.
Получение:
1)Cu+H2SO4конц=CuSO4+SO2+H2O
SO2+H2O=H2SO3
2)FeS2+11O2=2Fe2O3+8SO2
Na2SO3 + H2O ⇄ NaOH + NaHSO3
Химические свойства сернистой кислоты
1. Сернистая кислота (формула H2SO3) может использоваться в качестве восстановителя или окислителя.
H2SO3 является хорошим восстановителем. С ее помощью можно из свободных галогенов получить галогеноводороды. Например:
H2SO3 (кислота сернистая) + Cl2 (хлор, газ) + H2O (вода) = H2SO4 (кислота серная) + 2HCl (соляная кислота)
Но при взаимодействии с сильными восстановителями данная кислота будет выполнять роль окислителя. Примером может послужить реакция сернистой кислоты с сероводородом:
H2SO3 (кислота сернистая) + 2H2S (сероводород) = 3S (сера) + 3H2O (вода)
2. Рассматриваемое нами химическое соединение образует два вида солей - сульфиты (средние) и гидросульфиты (кислые). Эти соли являются восстановителями, так же, как и (H2SO3) сернистая кислота. При их окислении образуются соли серной кислоты. При прокаливании сульфитов активных металлов образуются сульфаты и сульфиды. Это реакция самоокисления-самовосстановления. Например:
4Na2SO3 (сульфит натрия) = Na2S (сульфид натрия) + 3Na2SO4 (сульфат натрия)
Сульфиты натрия и калия (Na2SO3 и K2SO3) применяются при крашении тканей в текстильной промышленности, при отбеливании металлов, а также в фотографии. Кальция гидросульфит (Ca(HSO3)2), существующий только в растворе, используется для переработки древесного материала в специальную сульфитную целлюлозу. Из нее потом делают бумагу.
Качественная реакция на сульфит-ионы — обесцвечивание раствора перманганата калия: 5SO32- + 6H+ + 2MnO4- → 5SO42- + 2Mn2+ + 3H2O.
Сульфит-ион как лиганд:
Cu2SO3+SO32-→[Cu(SO3)2]3-+…
SO2+H2O=SO2*H2O=H2SO3=H(+)+HSO3(-) Ka=1,3*10(-2) HSO3(-)=H(+)+SO3(-2) Ka=6,2*10(-8)
15.Аммиакаты металлов, реакции их получения и разрушения. Равновесия в растворах аммиакатов.
Аммиака́ты (амми́ны, аммѝноко́мплексы) — продукты взаимодействия солей с аммиаком, комплексные соединения, содержащие в качестве лигандов молекулы аммиака. Лиганды NH3 связаны в аммиакатах с центральным атомом металла через азот.
Аммиакаты различаются как по составу [Ag(NH3)2]+, [Ni(NH3)4]2+, так и по устойчивости в водных растворах. Используются в аналитической химии для обнаружения и разделения ионов металлов, как лекарственные средства при лечении онкологических заболеваний.
Аммины могут быть как анионного, так и катионного типа; существуют также аммины-неэлектролиты, например [PtCl2(NH3)2].
Получение.
Аммиачные комплексы обычно получают при взаимодействии солей или гидроксидов металлов с аммиаком в водных или неводных растворах, либо обработкой тех же солей в кристаллическом состоянии газообразным аммиаком:
AgCl(т) + 2 NH3 . H2O = [Ag(NH3)2]Cl + 2 H2O
Cu(OH)2(т) + 4 NH3 . H2O = [Cu(NH3)4](OH)2 + 4 H2O
NiSO4 + 6 NH3 . H2O = [Ni(NH3)6]SO4 + 6 H2O
CoCl2 + 6 NH3(г) = [Co(NH3)6]Cl2
В тех случаях, когда аммиачный комплекс неустойчив в водном растворе, его можно получить в среде жидкого аммиака:
AlCl3(s) + 6 NH3(ж) = [Al(NH3)6]Cl3(s)
Водный раствор аммиака при взаимодействии с ионами меди(II) сначала осаждает основные соли переменного состава зеленого цвета, легкорастворимые в избытке реагента. При этом образуется аммиачный комплекс меди сине-фиолетового цвета: Cu2+ + 4NH4OH = [Cu(NH3)4]2+ + 4H2O
Химическая связь молекул аммиака с комплексообразователем устанавливается через атом азота, который служит доноромнеподеленной пары электронов.
Образование амминокомплексов в водных растворах происходит путем последовательного замещения молекул воды во внутренней сфере аквакомплексов на молекулы аммиака:
[Cu(H2O)4]2+ + NH3 . H2O 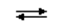 [Cu(H2O)3(NH3)]2+ + 2 H2O;
[Cu(H2O)3(NH3)]2+ + 2 H2O;
[Cu(H2O)3(NH3)]2+ + NH3 . H2O 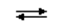 [Cu(H2O)2(NH3)2]2+ + 2H2O
[Cu(H2O)2(NH3)2]2+ + 2H2O
Разрушение.
Аммиакаты разрушаются при любых воздействиях, которые удаляют (при нагревании) или разрушают (действием окислителя) молекулу аммиака, переводят аммиак в кислотной среде в катион аммония (катион аммония не содержит неподеленных пар электронов и поэтому не может выполнять функции лиганда), либо связывают центральный атом комплекса, например, в виде малорастворимого осадка:
[Ni(NH3)6]Cl2 = NiCl2 + 6 NH3(г)
[Cu(NH3)4]SO4 + 6 Br2 = CuSO4 + 12 HBr + 2 N2(г)
[Ni(NH3)6]SO4 + 3 H2SO4 = NiSO4 + 3 (NH4)2SO4
[Cu(NH3)4](OH)2 + Na2S + 4 H2O = CuS¯ + 2 NaOH + 4 NH3 . H2O
Равновесия в растворах аммиакатов.
Растворы аммиакатов довольно устойчивы, за исключением аммиаката кобальта(II) жёлто-бурого цвета, который постепенно окисляется кислородом воздуха в аммиакат кобальта(III) вишнёво-красного цвета. В присутствии окислителей эта реакция протекает мгновенно.
Образование и разрушение комплексного иона объясняется смещением равновесия его диссоциации. В соответствии с принципом Ле Шателье (если на систему, находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-либо из условий равновесия (температура, давление, концентрация, внешнее электромагнитное поле), то в системе усиливаются процессы, направленные на компенсацию внешнего воздействия) равновесие в растворе аммиачного комплекса серебра смещается в сторону образования комплекса (влево) при увеличении концентрации Ag+ и/или NH3. При уменьшении концентрации этих частиц в растворе равновесие смещается вправо, и комплексный ион разрушается. Это может быть обусловлено связыванием центрального иона или лигандов в какие-либо соединения, более прочные, чем комплекс. Например, при добавлении азотной кислоты к раствору [Ag(NH3)2]Cl происходит разрушение комплекса вследствие образования ионов NH4+, в котором аммиак связан с ионом водорода более прочно:
[Ag(NH3)2]+ + 2Н+ → Ag+ + 2NH4+.
Для [Ag(NH3)2]+ Кн = 9,3·10−8, а для NH4+ Кн = 6·10-10.
Для аммиакатов характерна амидореакция — отщепление водорода от NH3 при взаимодействии с основаниями, например
[PtCl(NH3)5]Cl3 + KOH → [PtCl(NH3)4(NH2)]Cl2 + KCl + H2O
Благодаря этому аммиакаты в водных растворах обладают кислотными свойствами.
16. Получение серной кислоты. Олеум. Действие концентрированной кислоты на металлы и неметаллы.
Се́рная кислота́ H2SO4 — сильная двухосновная кислота, отвечающая высшей степени окисления серы (+6). При обычных условиях концентрированная серная кислота — тяжёлая маслянистая жидкость без цвета и запаха, с кислым «медным» вкусом.
 2018-01-21
2018-01-21 4837
4837
