В промышленности серную кислоту получают окислением диоксида серы (сернистый газ, образующийся в процессе сжигания серы или серного колчедана) до триоксида (серного ангидрида)с последующим взаимодействием SO3 с водой. Получаемую данным способом серную кислоту также называют контактной (концентрация 92-94 %).
2SO2 + O2 (V2O5 кат) → 2SO3 SO3 + H2O → H2SO4 химически чистый
Нитрозный (башенный) способ.
2NO+O2=2NO2
NO2+SO2=SO3+NO
SO2+NO2+H2O=H2SO4+NO
Раньше серную кислоту получали исключительно нитрозным методом в специальных башнях, а кислоту называли башенной (концентрация 75 %). Сущность этого метода заключается в окислении диоксида серы диоксидом азота в присутствии воды.
2NO+O2 → 2NO2 SO2 + NO2 → SO3 + NO↑. SO3 + H2O → H2SO4
Олеум.
О́леум (лат. Oleum) — раствор серного ангидрида SO3 в 100%-й серной кислоте H2SO4.
Олеум представляет собой вязкую маслянистую бесцветную жидкость или легкоплавкие кристаллы, которые, однако, могут приобретать самые различные оттенки вследствие наличия примесей. На воздухе «дымит», реагирует с водой с выделением очень большого количества тепла. Концентрация серного ангидрида может варьировать в очень широких пределах: от единиц до десятков процентов. Олеум по сравнению с концентрированной серной кислотой обладает ещё большим водоотнимающим и окислительным действием. Температура кипения олеума с увеличением содержания SO3 понижается.
Действие концентрированной кислоты на металлы и неметаллы.
С металлами:
1) от Li до Mg: M + H2SO4=MSO4 + H2O + H2S
2) от Sc до Ni: M + H2SO4=MSO4 + H2O + S
3) от Sn до Hg: M + H2SO4=MSO4 + H2O + SO2
Al, Cr, Fe под действием конц кислоты пассивируются при н.у., но при нагревании оксидная пленка разрушается, реакция протекает: Fe + H2SO4= Fe2(SO4)3 + SO2 + H2O.
С неметаллами:
+C=t=2SO2 + CO2 + 2H2O
+2P=t=5SO2 + 2H3PO4+2H2O
+S=t=3SO2 + 2H2O
+Si=X(не идет)
H2SO4+H2S=SO2+S+2H2O
17.Ртуть, электронная конфигурация атома. Степени окисления, отношение к серной и азотной кислотам. Галогениды ртути, комплексные соединения ртути.
1)Hg: [Xe]: 


Физические свойства:
Руть является единственным жидким металлом при комнатной температуре.
Ртуть проявляет еще одно уникально свойство - это единственный элемент, кроме благородных газов, являющийся в парах полностью одноатомным.
Электрическое сопротивление жидкой ртути является исключительно высоким для металла, поэтому она используется в качестве электрического стандарта (международный “Ом” определяется как сопротивление 14,4521 г ртути в колонке длиной 106,300 см и площадью 1мм2 при температуре 0 град.цельсия и давлении 760 мм рт.ст.).
Hg
t плавл., в гр.цельс. -38,87
t кип,в гр.цельс. 356,58
p (плотность) г/см3 13,5951
Многие соединения ртути,как и сама ртуть,очень токсичны.
2) Hg чаще всего находится в степени окисления (+2).Исключеснием являются производные иона  ,который формально содержит ртуть в степени окисления (+1).
,который формально содержит ртуть в степени окисления (+1).
3)Hg не реагирует с разбавленными кислотами, однако растворяется в концентрированной азотной кислоте и горячей концентрированной серной кислоте с образованием солей ртути (2) (наряду с оксидами азота и серы):
Hg + 4HNO3(конц) = Hg(NO3)2 + 2NO2+ 2H2O
Hg+2H2SO4(конц.,гор.)=HgSO4+SO2+2H2O.
Разбавленная азотная кислота медленно образует нитрат диртути:
6Hg+8HNO3=3Hg2(NO3)2+2NO+4H2O.
4)Полярность связей в галогенидах ртути(2) HgГ2(Г=Cl,Br,I) еще меньше, чем в соответствующих галогенидах цинка и кадмия. Эти соединения легко образуются из простых веществ и представляют собой летучие и низкоплавкие твердые вещества, растворимые во многих органических растворителях. Их растворимость в воде, где они существуют почти исключительно в виде молекул HgX(2), уменьшается с ростом молекулярной массы (HI2 очень мало растворим в воде). Они могут быть осаждены в безводном состоянии из водных растворов реакциями обмена.
Кристаллы хлорида ртути(2) HgCl2 состоят из линейных молекул Cl-Hg-Cl (длина связи Hg-Cl равна 225 пм), а бромид ртути(2) HgBr2 и иодид рути HgI2 имеют слоистое строение. Однако, хотя координационное число ртути(2) в бромиде можно считать равным 6, две связи Hg-Br намного короче, чем остальные четыре (248 и 323 пм,соответственно).В Красной модификации иодида атом ртути(2) имеет тетраэдрическую координацию (КЧ 4); длина связи Hg-I равна 278 пм. При температуре выше 126 град.цельсия HgI2 существует в виде желтой формы,подобной HgBr2. В газообразном состоянии все три галогенида ртути(2) существуют в виде дискретных линейных молекул HgX2. Длины связи Hg-X в этих молекул составляют 228 пм(Hg-Cl), 240 пм(Hg-Br) и 257 пм (Hg-I).
Хлорид ртути(2) HgCl2 (сулема) ранее получали сублимацией из смеси сульфата ртути(2) и хлорида натрия и использовали как антисептик и яд. Это соединение растворимо в воде. В Водном растворе хлорида ртути(2) ионов очень мало. Константа равновесия обратимого процесса
2HgCl2  Hg2+ + [HgCl4]2-
Hg2+ + [HgCl4]2-
имеет порядок  .
.
Хлорид ртути(2) может быть восстановлен до хлорида диртути HgCl2:
2HgCl2 + [SnCl3]- + Cl- = Hg2Cl2 + [SnCl6]2-;
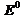 (HgCl2/Hg2Cl2) = 0,66 В.
(HgCl2/Hg2Cl2) = 0,66 В.
Галогениды диртути являются наиболее известными соединениями ртути(1) и всегда содержат ион  . Фторид диртути Hg2F2 синтезируют в несколько стадий. Сначала по реакции разбавленной азотной кислоты с избытком металлической рутти получают нитрат диртути Hg2(NO3)2. Действием гидрокардоната натрия NaHCO3 на водный раствор этого соединения осаждают карбонат диртути Hg2CO3, который при взаимодействии с фтороводородом в водном растворе образует фторид диртути Hg2F2. Фторид диртути растворяется в воде, но тут же гидролизуется до “черного оксида”, который,очевидно, является смесью металлической ртути и оксида ртути(2).При нагревании фторид ртути диспроционирует до металла и фторида ртути(2).
. Фторид диртути Hg2F2 синтезируют в несколько стадий. Сначала по реакции разбавленной азотной кислоты с избытком металлической рутти получают нитрат диртути Hg2(NO3)2. Действием гидрокардоната натрия NaHCO3 на водный раствор этого соединения осаждают карбонат диртути Hg2CO3, который при взаимодействии с фтороводородом в водном растворе образует фторид диртути Hg2F2. Фторид диртути растворяется в воде, но тут же гидролизуется до “черного оксида”, который,очевидно, является смесью металлической ртути и оксида ртути(2).При нагревании фторид ртути диспроционирует до металла и фторида ртути(2).
Другие галогениды практически нерастворимы в воде. Они могут быть осаждениы из водных растворов нитрата диртути добавлением галогенид-ионов.С другой стороны, их можно получить при взаимодействии галогенидов ртути(2) с металлом. Хлорид диртути Hg2Cl2 и бромид диртути HgBr2 легко испаряются и в парах разлагаются до металла и соответствующего галогенида ртути(2).
Иодид ртути Hg2I2 разлагается при более низких температурах. Присутствие металла может служить причиной зеленоватого оттенка, часто наблюдаемого в образцах этого обычно желтого твердого вещества.
5)Cоединения ртути(1) можно получать восстановлением солей ртути(2), часто самим металлом, или осаждением из водных растворов нитратов. Нитрат диртути известен в виде дигидрата Hg2(NO3)2*2H2O. Он устойчив в воде при подкислении; в нейтральной среде осаждаются основные соли, такие как Hg(OH)(NO3) и Hg2(OH)(NO3).
При приготовлении растворов солей ртути(2) требуется подкислении среды для предотвращения образования частиц с гидроксо-мостиками или осаждения основных солей, таких как Hg(OH)(NO3):
Hg(NO3)2+H2O=Hg(OH)(NO3)+HNO3.
Ртуть(2) не образует прочных ковалентных связей с кислородом. Тем не менее, известны комплексы ртути(2), в которых лиганды координированы через атомы кислорода. Так, в присутствии избытка [NO3]- в водном растворе нитрата образуется комплексный анион [Hg(NO3)4]2-, в котором 8 атомов кислорода из бидентатных нитратных групп находятся на одинаковом расстоянии от атома ртути. Правильная октаэдрическая координация найдена в комплексах с другими О-донорными лигандами, например, в [Hg(H2O)6]2+.
Наиболее обычный тип координации в комплексах ртути(2) с другими донорными атомами - искаженный октаэдр с двумя связями, намного более короткими, чем остальные четыре. В предельном случае это приводит к линейной координации (КЧ 2).
В случае избытка цианид- или тиоцианат-ионов образуются комплексные анионы [HgX3]- и тетраэдрические [HgX4]2-. Подобные комплексные ионы образуются и для галогенов.
Комплексы ртути являются термодинамически наиболее устойчивыми,чем комплексы цинка(2) и кадмия(2).Поэтому очень малорастворимый иодид ртути(2) в присутствии ионов I- переходит в раствор. Даже при сильном подщелачивании полученного раствора осадок не выпадает.
Такой раствор известен как реактив Несслера, который используется в качестве чувствительного реагента на аммиак: появляется желтая или коричневая окраска в результате образования Hg2NI*H2O:
2K2[HgI4]+3KOH + NH3=Hg2NI*H2O+7KI+2H2O.
Полученное соединение ртути можно рассматривать как иодидную соль основания Миллона.Основание Миллона называют соединение состава [Hg2N(OH)*(H2O)2], которое удобнее всего получать нагреванием желтого оксида ртути(2) с водным раствором аммиака.
Образование соединений подобного типа отражает характерную способность ртути давать не только давать не только обычные амины и комплексы с аминами, но также, замещая водород, образовывать прямые связи с азотом, например:
HgCl2+2NH3=(HgNH2)Cl+NH4Cl.
Соединение (HgNH2)Cl выделяется в виде белого осадка. В присутствии избытка катиона [NH4]+, что подовляет протекание прямой реакции, и таких анионов как [NO3]- и [ClO4]-, которые мало склонны к координации, можно получить комплекс [Hg(NH3)4]2+. Однако в отсутствие этих предостороженностей скорее образуются аминосоединения, например, (Hg2N)Cl*H2O, часто вместе.
Создав высокую концентрацию [NH4]+, можно получить диамин [Hg(NH3)2Cl2], описанный как “плакий белый проципитат”:
HgCl2+2NH3= [Hg(NH3)2Cl2].
При использовании низкой концентрации амиака и в отсутсвие катионов [NH4]+ в начальный момент времени образуется амид [Hg(NH2)Cl] (“неплавкий белый преципитат”).
Соединение [Hg2NCl(H2O)], являющееся хлоридом основания Миллона, можно получить нагреванием диаммина или амида с водой или, что лучше? действием хлолроводородной кислоты на основание Миллона. Замещение [OH]- анионами дает ряд солей [Hg2NX(H2O)].
Hg2(NO3)2+4HNO3=2Hg(NO3)2+2NO- + 2H2O
Hg2Cl2+[SnCl]- + Cl- = 2Hg+[SnCl6]2-
HgS+O2=Hg+SO2
3HgS+8HNO3+6HCl=3HgCl2+3H2SO4+8NO+4H2O
2NaHg(амальгат натрия)+2H2O=2Hg+2NaOH+H2
Hg2Cl2=HgCl2+Hg
18. Химическая связь в комплексных соединениях (приведите примеры). Виды изомерии комплексных соединений.
Для характеристики химической связи в координационных соединениях в настоящее время наиболее широко используются следующие теории: валентных связей, кристаллического поля и молекулярных орбиталей. Все они описывают химическую связь приближенно и каждая из них имеет свои достоинства и недостатки.
1)Метод валентных связей является весьма наглядным способом описания комплексных соединений. В его основе лежат следующие положения:
1. Связь между комплексообразователем и лигандами донорно-акцепторная σ-типа. Лиганды предоставляют электронные пары, а ядро комплекса – свободные орбитали.
2. Орбитали центрального атома, участвующие в образовании связи, подвергаются гибридизации, которая определяет геометрию комплекса. Тип гибридизации определяется числом, природой и электронной структурой лигандов.
3. Дополнительное упрочение комплекса обусловлено тем, что наряду с σ -связями могут возникать и π -связи. Это происходит, если занятая электронами орбиталь центрального атома перекрывается с вакантной орбиталью лиганда.
4. Магнитные свойства комплекса объясняются исходя из заселённости орбиталей. При наличии неспаренных электронов комплекс парамагнитен. Спаренность электронов обусловливает диамагнетизм комплексного соединения.
Рассмотрим, как МВС описывает электронную структуру и свойства некоторых комплексов, образованных 3d–элементами: кобальтом, никелем и медью. В таблице собственные электроннные пары комплексообразователей изображены сплошными стрелками, а электронные пары лигандов, ответственные за донорно-акцепторные σ -связи, представлены пунктирными стрелками.

Наряду с моноядерными комплексами, включающими только один центральный атом, существуют полиядерные, в структуре которых одновременно присутствуют два или несколько центральных атомов-комплексообразователей.
2)В теории кристаллического поля химическая связь комплексообразователь – лиганд считается электростатической. В соответствии с этой теорией лиганды располагаются вокруг комплексообразователя в вершинах правильных многогранников (полиэдров) в виде точечных зарядов. Реальный объем лиганда теорией во внимание не принимается.
Лиганды, как точечные заряды, создают вокруг комплексообразователя электростатическое поле (“кристаллическое поле”, если рассматривать кристалл комплексного соединения, или поле лигандов), в котором энергетические уровни комплексообразователя и прежде всего d -подуровни расщепляются, и их энергия изменяется. Характер расщепления, энергия новых энергетических уровней зависит от симметрии расположения лигандов (октаэдрическое, тетраэдрическое или иное кристаллическое поле). Когда в качестве лигандов координируются молекулы H2O, NH3, CO и другие, их рассматривают как диполи, ориентированные отрицательным зарядом к комплексообразователю.
Рассмотрим случай октаэдрического расположения лигандов (например, [CoF6]3- или [Co(NH3)6]3+). В центре октаэдра находится атом-комплексообразователь М(+n) с электронами на d -атомных орбиталях, а в его вершинах – лиганды в виде точечных отрицательных зарядов (например, ионы F- или полярные молекулы типа NH3). В условном ионе М(+n), не связанном с лигандами, энергии всех пяти d -АО одинаковы (т.е. атомные орбитали вырожденные).
Однако в октаэдрическом поле лигандов d -АО комплексообразователя попадают в неравноценное положение. Атомные орбитали d (z 2) и d (x 2- y 2), вытянутые вдоль осей координат, ближе всего подходят к лигандам. Между этими орбиталями и лигандами, находящимися в вершинах октаэдра, возникают значительные силы отталкивания, приводящие к увеличению энергии орбиталей. Иначе говоря, данные атомные орбитали подвергаются максимальному воздействию поля лигандов. Физической моделью такого взаимодействия может служить сильно сжатая пружина.

Другие три d -АО – d (xy), d (xz) и d (yz), расположенные между осями координат и между лигандами, находятся на более значительном расстоянии от них. Взаимодействие таких d -АО с лигандами минимально, а следовательно – энергия d (xy), d (xz) и d (yz)-АО понижается по сравнению с исходной.
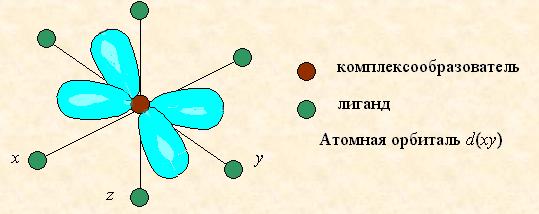
Таким образом, пятикратно вырожденные d -АО комплексообразователя, попадая в октаэдрическое поле лигандов, подвергаются расщеплению на две группы новых орбиталей – трехкратно вырожденные орбитали с более низкой энергией, d (xy), d (xz) и d (yz), и двукратно вырожденные орбитали с более высокой энергией, d (z 2) и d (x 2- y 2). Эти новые группы d -орбиталей с более низкой и более высокой энергией обозначают d e и d g:
Разность энергий двух новых подуровней d e и d g получила название параметра расщепления D0:
E 2 – E 1 = D0
Расположение двух новых энергетических подуровней d e и d g по отношению к исходному (d -АО) на энергетической диаграмме несимметричное:
(Е 2 – Е 0) > (Е 0 – Е 1).
Квантово-механическая теория требует, чтобы при полном заселении новых энергетических уровней электронами общая энергия осталась без изменения, т.е. она должна остаться равной Е 0.
Иначе говоря, должно выполняться равенство
4(Е 2 – Е 0) = 6(Е 0 – Е 1),
где 4 и 6 – максимальное число электронов на d g- и d e-АО. Из этого равенства следует, что
(Е 2 – Е 0) / (Е 0 – Е 1) = 3/2 и
(Е 2 – Е 1) / (Е 0 – Е 1>) = 5/2, или
D0 / (Е 0 – Е 1) = 5/2, откуда (Е 0 – Е 1) = 2/5 ´ D0>.
Размещение каждого электрона из шести максимально возможных на d e-орбитали вызывает уменьшение (выигрыш) энергии на 2/5 D0.
Наоборот, размещение каждого электрона из четырех возможных на d g-орбитали вызывает увеличение (затрату) энергии на 3/5 D0.
Если заселить электронами d e- и d g-орбитали полностью, то никакого выигрыша энергии не будет (как не будет и дополнительной затраты энергии):
4 ´ 3/5 ´ D0 - 6 ´ 2/5 ´ D0 = 0.
Но если исходная d -АО заселена только частично и содержит от 1 до 6 электронов, и эти электроны размещаются только на d e-АО, то мы получим значительный выигрыш энергии.
Выигрыш энергии за счет преимущественного заселения электронами d e-атомных орбиталей называют энергией стабилизации комплекса полем лигандов.
Специфика каждого из лигандов сказывается в том, какое поле данный лиганд создает – сильное или слабое. Чем сильнее поле лигандов, чем больше значение параметра расщепления D0.
Изучение параметра расщепления, как правило, основано на спектроскопических исследованиях. Длины волн полос поглощения комплексов l в кристаллическом состоянии или в растворе, обусловленные переходом электронов с d e- на d g-АО, связаны с параметром расщепления D0 следующим образом:
n = 1 / l; D0 = Е 2 – Е 1 = h ´ n = h ´ (c / l) = h ´ c ´ n,
где постоянная Планка h равна 6,626 ´ 10-34 Дж . с;
скорость света с = 3 ´ 1010 см/с.
Единица измерения D0 – та же, что у волнового числа n: см-1, что приближенно отвечает 12 Дж/моль.
Параметр расщепления, помимо типа лиганда, зависит от степени окисления и природы комплексообразователя.
В комплексных соединениях, включающих комплексообразователи одного и того же периода и в одинаковой степени окисления, с одними и теми же лигандами, параметр расщепления примерно одинаков. С ростом степени окисления комплексообразователя значение D0 увеличивается. Так, для аквакомплексов [Mn(H2O)6]2+ и [Fe(H2O)6]2+ значение параметра расщепления составляет 7800 и 10400 см-1, а для [Mn(H2O)6]3+ и [Fe(H2O)6]3+ - 13700 и 21000 см-1 соответственно.
При увеличении заряда ядра атома-комплексообразователя D0 тоже растет. Катионы гексаамминкобальта(III) [Co(NH3)6]3+,гексаамминродия(III) [Rh(NH3)6]3+, гексаамминиридия(III) [Ir(NH3)6]3+ (Z = 27, 45 и 77) характеризуются параметрами расщепления, равными 22900, 34100 и 41000 см-1.
Зависимость D0 от природы лигандов более разнообразна. В результате исследования многочисленных комплексных соединений было установлено, что по способности увеличивать параметр расщепления металлов-комплексообразователей, находящихся в своих обычных степенях окисления, наиболее распространенные лиганды можно расположить в следующий спектрохимический ряд, вдоль которого значение D0 монотонно растет:
I- < Br- < Cl-» NCS- < < NO3- < F- < OH- < H2O» H- < NH3 < NO2- < CN-» NO» CO.
Таким образом, наиболее сильное электростатическое поле вокруг комплексообразователя и самое сильное расщепление d -АО вызывают лиганды NO2-, CN- и CO.
Рассмотрим распределение электронов по d e- и d g-орбиталям в октаэдрическом поле лигандов. Заселение d e- и d g-орбиталей происходит в полном соответствии с правилом Гунда и принципом Паули. При этом независимо от значения параметра расщепления первые три электрона занимают квантовые ячейки d e-подуровня:

Если число электронов на d -подуровне комплексообразователя больше трех, для размещения их по расщепленным подуровням появляется две возможности. При низком значении параметра расщепления (слабое поле лигандов) электроны преодолевают энергетический барьер, разделяющий d e- и d g-орбитали; четвертый, а затем и пятый электроны заселяют квантовые ячейки d g-подуровня. При сильном поле лигандов и высоком значении D0 заселение четвертым и пятым электроном d g-подуровня исключено; происходит заполнение d e-орбиталей.

Шестой, седьмой и восьмой электроны в случае слабого поля оказываются снова на d e-подуровне, дополняя конфигурации до электронных пар (одной в случае d 6, двух – d 7 и трех – d 8):

В случае сильного поля лигандов шестой электрон заселяет d e-АО, приводя к диамагнетизму комплекса, после чего седьмой и восьмой электроны поступают на d g-подуровень:

Очевидно, при восьмиэлектронной конфигурации различия в строении между комплексами с лигандами слабого и сильного поля исчезают. Заселение орбиталей девятым и десятым электроном также не различается для комплексов обоих типов:

Вернемся к рассмотрению электронного строения октаэдрических комплексных ионов [Co(NH3)6]3+ и [CoF6]3-. В соответствии с расположением в спектрохимическом ряду, аммиак NH3 относится к числу лигандов сильного поля, а фторид-ион F- – слабого поля. Следовательно, заселение электронами атомных орбиталей в данных комплексах будет происходит по схеме:
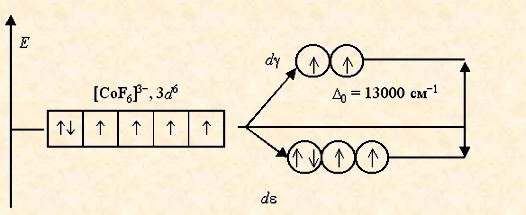
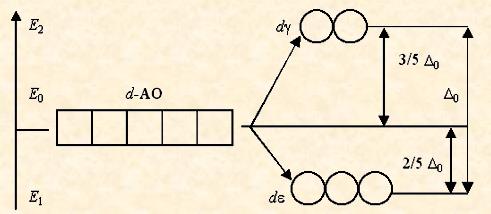
В анионе [CoF6]3- лиганды F- создают слабое кристаллическое поле (D 0 = 13000 см-1), и все электроны исходной 3 d 6-АО размещаются на d e- и d g-орбиталях без какого-либо спаривания. Комплексный ион является высокоспиновым и содержит четыре неспаренных электрона, поэтому он парамагнитен.

В ионе [Co(NH3)6]3+ лиганды NH3 создают сильное кристаллическое поле (D0 = 22900 см-1), все 3 d 6-электроны размещаются на более энергетически выгодной d e-орбитали. Переход электронов с d e- на d g-орбитали невозможен из-за слишком высокого энергетического барьера. Поэтому данный комплексный катион является низкоспиновым, он не содержит неспаренных электронов и диамагнитен.
Аналогичным образом могут быть представлены схемы распределения электронов по орбиталям в октаэдрическом поле для ионов[Fe(H2O)6]2+ и [Fe(CN)6]4-:
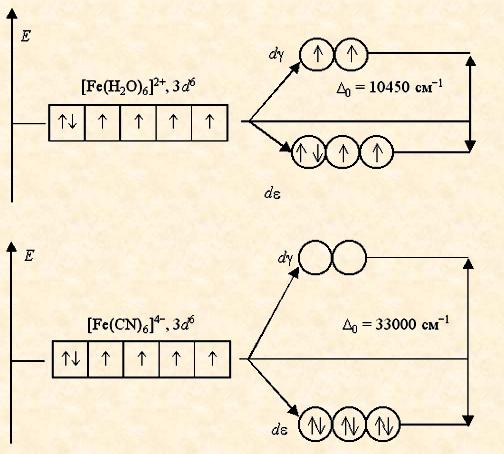
Лиганды H2O создают слабое поле; обмен электронами между d e- и d g-орбиталями не вызывает затруднений и поэтому число неспаренных электронов в комплексном ионе такое же, как и в условном ионе Fe+II. Получаемый аквакомплекс – высокоспиновый, парамагнитный.
Наоборот, лиганды CN- вызывают значительное расщепление d -АО, составляющее 33000 см-1. Это значит, что существует сильная тенденция к размещению всех электронов на d e-орбиталях. Выигрыш энергии, получаемый при таком заселении орбиталей, много больше энергетических затрат, обусловленных спариванием электронов.
3) Метод МО ЛКАО (молекулярные орбитали - линейная комбинация атомных орбиталей).
Если предположить, что
а) электрон "ощущает" потенциал ядра лишь вблизи этого ядра;
б) электрон может быть описан модификациями функций – решений задачи для атома водорода,
то можно построить систему одноэлектронных функций – молекулярных орбиталей. Дополнительно предполагают, что основную роль играют орбитали наименее связанных электронов атомов – валентные орбитали. Теоретическое обоснование таких предположений затруднительно, но модель наглядна.
При использовании водородоподобных орбиталей нужно помнить:
а) При графическом изображении угловых частей атомных орбиталей (шары и гантели) указывается область математического пространства, в которой с заданной вероятностью (чаще 0,9) находится электрон. Заряд электрона не "размазан" в этой области!
б) При изображении АО обязательно указывают знак волновой функции (+ или -) в отдельных частях АО. Знак важен для расчетов, но не имеет физического смысла.
в) Для удобства расчетов часто используют одноэлектронные функции, простирающиеся на всю молекулу. Для построения таких молекулярных орбиталей используют не сами атомные орбитали, а их линейные комбинации – гибридные орбитали.
г) В рамках рассмотрения гибридных МО важное значение имеет интеграл перекрывания между АО. АО должны обладать одинаковой симметрией по отношению к вращениям и отражениям и иметь близкие энергии. В таких терминах очень хорошо описываются соединения элементов 2-го периода.
Диаграммы МО (молекулярных орбиталей)
Обычно в учебниках приводится готовая схема (схемы) с не очень понятными объяснениями, поскольку диаграммы являются результатом достаточно сложных расчетов. При построении МО в приближении ЛКАО исходят не из готовых атомов, а из готового ядерного остова (например, из двух ядер атомов Н) и затем выясняют, в каких возможных состояниях может находиться один электрон в потенциальном поле двухъядерного остова [ 5]. Затем это возможные молекулярные состояния (молекулярные орбитали) постепенно заполняют электронами в правильной энергетической последовательности (снизу вверх) и с учетом принципа Паули строят систему возможных (двухатомных) молекул, подобно тому, как в том же одноэлектронном приближении строили периодическую систему. Исходной моделью здесь служит молекулярный ион Н 2 +, который играет такую же роль, как и атом Н при построении атомных состояний.
Если о результатам расчетов электронная плотность между ядрами данной молекулярной орбитали повышена (>0), то орбиталь называют связывающей. Если электронная плотность между ядрами равна нулю, то орбиталь называют разрыхляющей или антисвязывающей. Энергия связывающей МО ниже исходных АО, разрыхляющей МО - выше исходных АО
Здравый смысл. Электростатически стабильно состояние, когда электроны находятся между двумя ядрами. При этом спиновая функция по принципу Паули должна быть антисимметричной.
19. Марганец. Электронная конфигурация атома, степени окисления. Соединения марган- ца, их свойства и применение. Напишите реакции превращений: Mn(IV) → Mn(VI) и Mn(II) → Mn(VII).
1)[Ar] 3d5 4s2. Характерные степени окисления марганца: +2, +3, +4, +6, +7 (+1, +5 мало характерны).
2)Mn2+ образует много соединений. Большенство солей Mn2+ растворимы.Аквокомплекс [Mn(H2O)6]2+ устойчивый парамагнитный высокоспиновый комплекс.Малорастворимый Mn(OH)2 осаждаемый при действии щелочей, обладает основными свойствами.Соединения Mn2+ устойчивы в кислой среде в отсутствии сильных окислителей. Сильные окислители в кислой среде – NaBiO3, (NH4)2S2O8 окисляют соединения Mn2+ в перманганат-ионы: 5Mn(NO3)2+5NaBiO3+16HNO3 =2
HMnO4 +5Bi(NO3)3 +5NaNO3+7H2O
В щелочной среде соединения Mn2+ неустойчивы, легко окисляются кислородом воздухе: Mn(OH)2+O2+2H2O=Mn(OH)4
MnO2 обладает амфотерными свойствами, однако и кислотные свойства марганцеватистой кислоты H2MnO3 и основные свойства Mn(OH)4 выражены очень слабо:
MnO2 +2KOH = K2MnO3 + H2O MnO2+ 4HCl = MnCl2 +Cl2+ H2O Mn(2+)+H2O2+OH(-)H2O+ MnO2 является полезным ископаемым, применяемым для получения металлического марганца и его солей. При перемалывании пиролюзита на мельницах образуется пыль, которая через легкие может проникать в организм людей и вызывать отравления. Используется как добавка к некоторым видам сталей, для обесцвечивания стекломассы, при изготовлении линолеума и некоторых лаков.
Mn2(CO)10=2Mn+10CO
MnO2+Fe2O3+5C=Mn+2Fe+5CO
3Mn3O4+8Al=9Mn+4Al2O3
Mn+S=MnS
4Mn+3O2=2Mn2O3 t=800 градусов
Mn+2HCl=MnCl2+H2
Mn+H2SO4=MnSO4+H2
Mn+2H2SO4конц=MnSO4+SO2+2H2O
MnO2+H2=MNO+H2O
Mn2(SO4)3+2HCLконц=Cl2+2MnSO4+H2SO4
4MnO2+6H2SO4конц=2Mn2(SO4)3+O2+6H2O
MnO2+4HCl конц =MnCl2+Cl2+2H2O
3K2MnO4+2H2SO4=MnO2+2KMnO4+2K2SO4+2H2O
2MnO2+O2+4KOH=2K2MnO4+2H2O
2K2MnO4+Cl2=2KMnO4+2KCl
2KMnO4=K2MnO4+MnO2+O2
2MnCl2+10CO=[Mn2(CO)10]+2Cl2
3)MnO2 обладает окислительно-восстановительной двойственностью:
MnO2+4HBr=MnBr2+Br2+2H2O
3MnO2+KClO3+6KOH=3K2MnO4+KCl+3H2O
Mn6+ неустойчивы. Слабая H2MnO4 существует только в водном растворе, в котором диспропорционирует:
3H2MnO4= 2 HMnO4+ MnO2+2H2O В кислой и нейтральной среде манганаты переходят в Mn2+ и MnO2
2KMnO4 + H2SO4 = Mn2O7 + K2SO4 + H2O
2KMnO4 + 10HCl + 3H2SO4 = 2MnSO4 + 5Cl2 + K2SO4 + 8H2O Перманганат калия является окислителем. Он применяется в медицине как дезинфизирующее средство. Отмечены случаи применения перманганата калия для криминальных абортов.
Напишите уравнения реакций:
1) 3MnO2 + KClO3 + 6KOH = 3KMnO4 + KCl + 3H2O
2) 2MnSO4 + 5PbO2 + 6HNO3 = 2HMnO4 + 3Pb(NO3)2 + 2PbSO4 + 2H2O.
Применение:
1) важная биологическая роль для всех форм жизни(суточная потребность взрослого человека в марганце 15 мг)
2) легированные(сплавленные) марганцем стали используются для изготовления пружин, рельсов, дробильных машин
3) В керамической промышленности MnO2 используют для окрашивания эмалей и глазурей в черный и темно-коричневый цвет
4) KMnO4 – антисептик для промывания ран, полоскания горла
20. Углерод. Аллотропные модификации. Угольная, циановодородная и циановая кисло- ты. Цианидные комплексы.
УГЛЕРОД (Carboneum) C, хим. элемент IV гр. периодич. системы, ат. н. 6, ат.м. 12.011. Природный углерод состоит из двух стабильных изотопов - 12C (98,892%) и 13C (1,108%). Конфигурация внеш. электронной оболочки атома углерода 2s22p2; степени окисления +4, - 4, редко +2 (СО, карбонилы металлов), +3 (C2N2, галоген-цианы); сродство к электрону 1,27 эВ;
Большинство соединений углерода, и прежде всего углеводороды, обладают ярко выраженным характером ковалентных соединений. Простые, двойные и тройные связи между атомами углерода достаточно прочные.
Аллотропные модификации..
Алмаз. В алмазе каждый атом углерода находится в состоянии sp3-гибридизации и образует четыре равноценные связи с другими атомами. Кристалл прозрачен в видимой части, характеризуется высоким коэффициентом преломления, имеет самую большую твердость из всех известных веществ, химически инертен. Тетраэдр 109 градусов
Графит – вторая кристаллическая форма углерода, в которой атомы находятся в состоянии sp2-гибридизации, имеет слоистую структуру. sp2-гибридные орбитали направлены к вершинам треугольника, поэтому в графите каждый атом углерода связан с тремя соседними, образуя плоскую сетку, и имеет один неспаренный электрон на негибридизированной p-орбитали, перпендикулярной к плоскости сетки. Все это определяет свойства графита: он мягок, легко расплавляется, имеет серый цвет и металлический блеск, электропроводен и химически более активен чем алмаз. шестиугольник
Карбин. Аллотропная модификация углерода основанная на sp-гибридизации. Цепи имеют либо полииновое строение, либо поликумуленовое. Известно неск. форм карбина, отличающихся числом атомов в элементарной ячейке, размерами ячеек и плотностью. Кабин встречается в природе в виде минерала чаоита и получен искусственно.альфа-карбин: ---c---c---c--- превр в щавел к-ту
бетта карбин: --с--с--с--с--с--с превр в угол к-ту при дейтсвии озона(О3)
Фуллерены. Фуллерены являются единственной из трех известных в настоящее время аллотропных модификаций углерода (графит, алмаз, фуллерены), которые обладают растворимостью в широком классе органических растворителей. Такая особенность фуллеренов связана с их молекулярной структурой, в отличие от сшитых полимерных сеток графита и алмаза. Окисляя фуллерен сильным окислителем, образуется CO, окисляя O2 – получается CO, окисляя не очень сильными окислителями – получается C. Фуллеренсодержащая сажа (Ф-сажа) представляет собой мелкодисперсный порошок черного цвета, основную долю которого (80-90 % по массе) составляет аморфный углерод. Остальные 10-20 % по массе Ф-сажи составляют фуллерены.
 2018-01-21
2018-01-21 1476
1476
