Угольная кислота - H2CO3, образуется при растворении CO2 в воде. Проявляет св-ва слабой к-ты. РавновесиеCO2+H2O H2CO3 смещено влево, поэтому меньшая часть CO2 находится в р-ре в виде H2CO3. Наиб. важные производные угольной кислоты: соли - карбонаты и гидрокарбонаты и эфиры. Соли встречаются в природе в виде минералов. Дихлорангид-рид угольной кислоты- фосген, моно- и диамид угольной кислоты- соотв. карбаминовая кислота и карбамид.
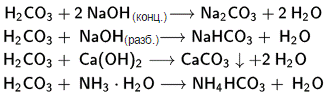

Циановодородная кислота. HCN
Бесцветная, очень летучая, легкоподвижная ядовитая жидкость, имеющая характерный запах. Синильная кислота содержится в некоторых растениях, коксовом газе, табачном дыме, выделяется при термическом разложении нейлона, полиуретанов. Смешивается во всех соотношениях с водой, этанолом, диэтиловым эфиром. Молекула HCN сильно полярна. Безводный циановодород является сильно ионизирующим растворителем, растворенные в нём электролиты хорошо диссоциируют на ионы. Соли этой кислоты называются цианидами. Взаимодействует с оксидами и гидроксидами щелочных и щёлочноземельных металлов.
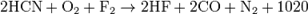 Кдж.
Кдж.
KOH(конц.) + HCN = KCN + H2O
Cl2+HCN=ClCN+HCl
2CH4+2NH3+3O2=2HCN+6H2O
NaNH2+C=NaCN+H2
C+2NH3+Na2CO3=2NaCN+3H2O
2KCN+O2=2KOCN(цианат)
ClCN+H2O=HCN+HOCN
NaCN+Cl2=NaCl+ClCN
Циановая кислота.
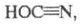 в своб. виде существует в виде изоформы (изоциановая к-та) HN = C = O, мол. м. 43,03; бесцв. жидкость с резким запахом, напоминающим запах уксусной к-ты;
в своб. виде существует в виде изоформы (изоциановая к-та) HN = C = O, мол. м. 43,03; бесцв. жидкость с резким запахом, напоминающим запах уксусной к-ты;
С NH3 циановая кислота дает цианат аммония NH4NCO, при нагр. превращающийся в мочевину (Н2N)2СО. В водных р-рах циановая кислота гидролизуется:
HNCO + H2O 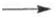 H2NCOOH
H2NCOOH  CO2 + NH3
CO2 + NH3
Разб. р-ры циановой кислоты в диэтиловом эфире, бензоле и толуоле устойчивы в течение длит. времени. В спиртовом р-ре циановая кислота превращается в эфиры аллофановой к-ты:
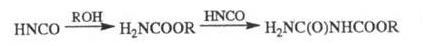
При недостатке циановой кислоты продуктом р-ции является уретан. С ненасыщенными соед. образует изоцианаты:
RCH = СН2 + HNCO  RCH2CH2NCO
RCH2CH2NCO
При т-ре ниже 150 °С циановая кислота полимеризуется, в осн. до линейного циамелида, выше 150 °С - до циклич. тримера – циануровой кислоты.
Циановую кислоту обычно получают деполимеризацией очищенной циануровой к-ты.
Получение: дегидратация углеаммиачной соли
HOCONH2=HOCONH2 + H2O
HOCONH2=HOCN+H2O
Hg(CNO)2=Hg+2CO+N2
2КОН + C2N2 = KOCN + KCN + H2O циан углерода
2KOCN + 4H2O = K2CO3 + (NH4)2CO3.
KCN+S=KSCN
Цианидные комплексы.
Цианид-ион – это лиганд сильного поля. Будучи отрицательно заряженным, — относительно плохой л-акцептор. Поэтому цианидные комплексы металлов в низкихстепенях окисления не так устойчивы, как соответствующие карбонильные производные.
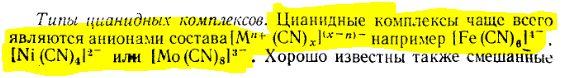
FeSO4 + K3[(СN)6] = KFe[Fe(CN)6] + K2SO4
Co2+ + 4SCN=[Co(SCN)4]2-
4Au + O2 + 8NaCN + 2H2O= 4Na[Au(CN)2] + 4NaOH
21. Метод валентных связей. Валентные возможности элементов. Механизмы образования ковалентной химической связи. σ-, π-, δ-связи.
Основные положения метода валентных связей, базирующиеся на квантово-механической теории строения атома, были разработаны Вальтером Гейтлером и Фритцем Лондоном в 1928 году. В последующем значительный вклад в развитие этого метода внесли Лайнус Полинг и Джон Слейтер.
Основные положения:
а) Химическая связь между 2 атомами возникает как результат перекрывания АО с образованием электронных пар (обобществление электронов);
б) Атомы, вступающие в химическую связь, обмениваются между собой электронами, которые образуют связывающие пары. Энергия обмена электронами между атомами вносит основной вклад в энергию химической связи. Дополнительный вклад в энергию связи дают кулоновские силы взаимодействия частиц;
в) В соответствии с принципом Паули химическая связь образуется лишь при взаимодействии электронов с антипараллельными спинами;
г) Характеристики химической связи определяются типом перекрывания АО;
д) Геометрия определяется только центральным атомом;
е) Связь жестко локализуется между двумя атомами.
ММО:
- все электроны системы находятся в поле всех ядер (электроны перемещаются в системе);
- химическая связь объясняется заполнением определенных молекулярных орбиталей.
Понятие о валентности элементов.
Вале́нтность — способность атомов химических элементов образовывать определённое число химических связей с атомами других элементов.
Согласно теории ВС, ковалентная связь направлена в сторону максимального перекрывания АО реагирующих атомов.
Обменный механизм
Способность атома присоединять или замещать определенное число других атомов с образованием химических связей называется валентностью.
Согласно обменному механизму метода ВС каждый атом отдает на образование общей электронной пары по одному неспаренному электрону. Количественной мерой валентности в обменном механизме метода ВС считают число неспаренных электронов у атома в основном или возбужденном состоянии.
При образовании химической связи атом может переходить в возбужденное состояние в результате разъединения пары (пар) электронов и переходе одного (или нескольких) электрона на свободную орбиталь той же оболочки.
Следует отметить, что у большинства d и f элементов на внешних оболочках в основном состоянии нет неспаренных электронов, поэтому их валентность равна 0, несмотря на то, что на предвнешних d и f подуровнях имеются неспаренные электроны. Последние не могут образовывать электронные пары с электронами других атомов, так как закрыты электронами внешней оболочки. [Железо Fe. В основном состоянии валентность равна 0. В возбужденном состоянии происходит разъединение 4s пары электронов. Максимальная валентность равна 6. У осмия Os при возбуждении могут разъединяться не только внешние 6s-электроны, но и предвнешние 5d электроны, поскольку в 5 оболочке имеется еще 5f-подоболочка со свободными орбиталями, поэтому максимальная валентность равна 8]
Донорно-акцепторный механизм
Обменный механизм метода ВС не может объяснить образования химических связей в некоторых соединениях. Например, у иона аммония атом азота образует четыре ковалентные связи с водородом, хотя у атома азота всего три неспаренных электрона. Четвертная ковалентная связь в ионе аммония появляется по донорно-акцепторному механизму, согласно которому образуется общая электронная пара за счёт неподеленной пары электронов (донора) и вакантной орбитали другого атома или иона (акцептора).
Четвертая ковалентная связь, образованная по донорно-акцепторному механизму, характеризуется теми же параметрами, что и остальные три ковалентные связи, образованные по обменному механизму. Все 4 связи равноценны.
Таким образом, суммарная валентность элемента равна числу неспаренных электронов (обменный механизм) плюс число связей, образованных по донорно-акцепторному механизму.
22. Оксид азота(II). Система молекулярных орбиталей для оксида азота(II). Получение в лабораторных и промышленных условиях. Свойства оксида азота(II). Оксид азота(II) как лиганд.
Оксид азота(II) (монооксид азота) NO. Образование из простых веществ идет без изменения числа молей и с небольшим увеличением энтропии. Можно получить прямым синтезом из смеси N2 + O2.
В промышленности монооксид азота получают каталитическим окисление аммиака.
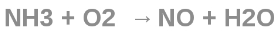
В лабораторной практике оксид азота получают в основном действием меди на не слишком концентрированнную азотную кислоту
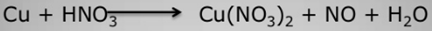
или:
6NaNO2+3H2SO4=4NO+2H2O+2HNO3+3Na2SO4
Оксид азота(II) быстро реагирует с кислородом, образует взрывчатую смесь с водородом, восстанавливается сернистым газом до N2O и окисляется галогенами с образованием NOГал(например NOCl). Таким образом, как окислительные, так и восстановительные свойства NO выражены достаточно сильно.
NO плохо растворим в воде и является безразличным газом.
ММО NO(II)
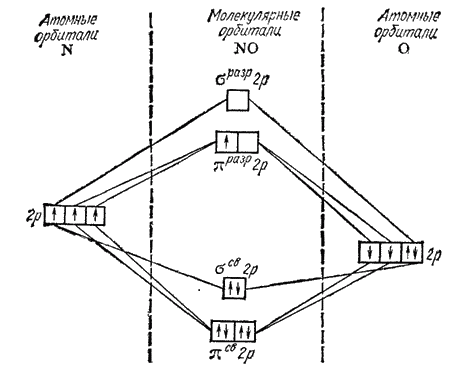
В комплексных соединениях NO (нитрозил). По своему характеру молекула NO относится к лигандам о- и я-донорного и л- акцепторного типа. Это объясняется тем, что в молекуле есть неподеленные электронные пары при атоме азота и непарный электрон в молекуле NO.
[Fe(H2O)6]2+ + NO=[Fe(H2O)5NO]2+ +H2O
N2O3+H2SeO4=(NO)2SeO4+H2O
2NO+Cl2=2NOCl
2NO+2H2S=N2+2S+2H2O
2NO+2CO=N2+2CO2
2NO+SO2=N2O+SO3
23. Золото, электронная конфигурация атома, степени окисления. Реагенты, растворяющие золото. Золотохлористоводородная и другие кислоты. Комплексы золота(I) и золота(III).
Золото (Au) химический элемент находящийся в первой группе ПС, ат.н. 79, ат.м. 196,9665; относится к благородным металлам. Золото - желтый металл; кристаллич. решетка гранецентрир. кубическая.
Электронная конфигурация 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s14f145d10
Степени окисления: +1, +3, редко +5
Золото не раств. в р-рах щелочей и к-тах, раств. в горячей H2SeO4, смесях к-т - Н2SО4 с HNO3, H2SO4 с НМnО4, а также в царской водке (НСl + НNO3) = Аu + HNO3 + 4НСl = H[AuCl4] + NO + 2Н2О; после осторожного выпаривания выделяются желтые кристаллы комплексной золотохлористоводородной к-ты НАuСl4.3Н2О. В водных р-рах цианидов (Na, Ca, К) при доступе О2 или др. окислителей золото раств. с образованием дицианоаурат-иона (цианирование): 2Au + 4CN- + Н2О + 0,5О2 = 2[Au(CN)2]- + 2OH-, что лежит в основе важнейшего пром. способа извлечения золота из руд. С галогенами в отсутствие влаги золото без нагревания не взаимод., при нагр. порошка золота в атмосфере галогенов образуются золота галогениды. С мн. металлами золото дает сплавы. На легком образовании амальгамы золота основан один из методов извлечения золота из горных пород. Соед. золота неустойчивы, в водных р-рах гидролизуются, легко восстанавливаются до металла.
Золотохлористоводородная кислота HAuCl4 является распространенным соединением золота и служит для получения большинства остальных соединений. Получение:
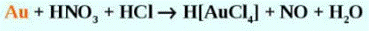
2Au+6H2SeO4=Au2(SeO4)3+3SeO2+6H2O
Au2O3+8HCl=2H[AuCl4]+3H2O
Au2O3+2KOH+H2O=2K[Au(OH)4]
В твердом состоянии HAuCl4 * 4H2O кристаллизуется. Очень гигроскопичная кислота, хорошо растворима в воде и других кислородсодержащих растворителях.
Водный раствор HAuCl4 - это сильный электролит, цвет раствора желтый, а при высоких концентрациях оранжевый. Кислота хорошо растворима в воде.
Являясь сильной кислотой, HAuCl4 может образовывать простые соли по реакциям нейтрализации или обмена без изменения аниона AuCl4-. По стандартной номенклатуре — тетрахлорауриаты, однако в настоящее время повсеместно используется название тетрахлороаураты или хлороаураты. Хорошо известны простые соли лития, натрия, калия, рубидия, цезия, аммония общей формулы MAuCl4• n H2O.
Являясь крупным анионом, AuCl4- способен осаждать многие крупные катионы, в том числе комплексные. Так, если Na[AuCl4] и K[AuCl4] хорошо растворимы, то соль Cs[AuCl4] малорастворима. Плохо растворима соль Tl[AuCl4] • 5 H2O
Для золота(III) получение аква-иона Au(H2O)43+ практически невозможно. Во-первых, он является сильной кислотой и нацело диссоциирует, отщепляя протоны и переходя в смешанные аквагидроксокомплексы. Во-вторых, аква-ион является сильным окислителем, и по этой причине тоже не может устойчиво существовать в водном растворе.
Тетрахлороаурат-ион AuCl4- способен окислять многие вещества, восстанавливаясь до золота(I) или золота(0). На этом основаны многие синтезы комплексов золота(I), особенно с органическими лигандами, когда часть лиганда расходуется на восстановление, а из части избытка формируется внутренняя сфера комплекса золота(I).
Для восстановления AuCl4- до металлического золота в кислой среде используют железо(II), сернистый газ или сульфитсодержащие препараты, органические восстановители, гидразин N2H4 или его соли
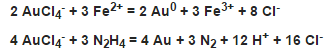
Для золота(III), и в частности для AuCl4-, важным процессом является диспропорционирование, которое регулирует соотношение между формами золота в разных степенях окисления 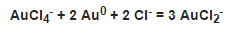
Дигидрат оксида золота (III) (золотая кислота) — Au2O3•2H2O, неорганическое комплексное соединение золота, производное оксида золота(III). Так как кислотный характер преобладает, то гидроксид золота(III) называют обычно золотой кислотой. Соли этой кислоты называются ауратами, например K[AuO2]·3·H2O — аурат(III) калия. Дигидрат оксида золота (III) легко распадается на оксид золота и воду.
Устойчивостькомплексов золота увеличивается при переходе от соединений Au (I) к производным Au (III).
| Au..5d106s1 CO: +1,+3 – основная СПОСОБЫ РАСТВОРЕНИЯ: Au + HNO3+4HCL => H[AuCl4]+NO+2H2O(царская водка) Au+3Cl+HCl =>H[AuCl4] Au+H2SeO4 =>Au2(SeO4)3+SeO2+H2O 4Au+O2+8CN-+2H2O =>4[Au+1(CN)2]-+4OH- Au+H2O+O2+NaCN => [Au(CN)3]2-РЕАКЦИЯБАГРАТИОНА [Au(CN)3]2-- ↔Au++3CN- Kн.общ. = ([〖Au〗^+ ] [〖CN〗^- ]^3)/〖[Au(CN)_3]〗^(2-) = 10-39 => КОМПЛЕКС ОЧЕНЬ КРЕПКИЙ КООРДИНАЦИОННОЕ ЧИСЛО 2 и 4 NaOH+Au+3(OH)3 = Na[Au+1(OH)4]ТЕТРОГИДРОКСОАУРАТНАТРИЯ Au+3(OH)3 + 4HNO3 = H[Au(NO3)4]+3H2O AuCl3+H2O-><- H[Au(OH)Cl3] большая склонность к образованию (аква кислота) AuCl3+H2O-><- H2[AuOCl3] анионных комплексов AuCl3+H2O+OH-=H3AuO3 ЗОЛОТАЯ КИСЛОТА (ПОХОЖА НА Al(OH)3) Au+HNO3+4HCl =>H[AuCl4]+NO+2H2O ЗОЛОТОХЛОРОВОДОРОДИСТАЯ КИСЛОТА AuCl3×H2O-аквокислота золота Для Au характерны галогенидные, аммиачные, цианидные и комплексы с серой и др. M+1 [Au(NO3)4] –ЦИАНО M+1 [AuS2] – СУЛЬФИДО СУЩЕСТВУЕТ Au+5 2Au+5KrF2 => 2AuF5+5Kr AuF5+KF => K[AuF6] |
Исследования показывают, чтокомплексы золота (III) диамагнитны и имеют плоско-квадратное строение. Водные комплексы Au+ диспропорцианируют в кислых водных растворах, и при действии достаточно сильных окислителей в кислых растворах образуются соединения Au(III).
24. Электродный потенциал. Факторы, влияющие на величину электродного потенциала. Стандартный электродный потенциал.
ЭЛЕКТРОДНЫЙ ПОТЕНЦИАЛ - разность электростатических потенциалов между электродом и находящимся с ним в контакте электролитом.
В окислительно-восстановительном процессе принимают участие 2 пары сопряженных окислителей и восстановителей, и направление реакции между ними определяется тем, какой окислитель и какой восстановитель сильнее.
Возьмем такую систему:
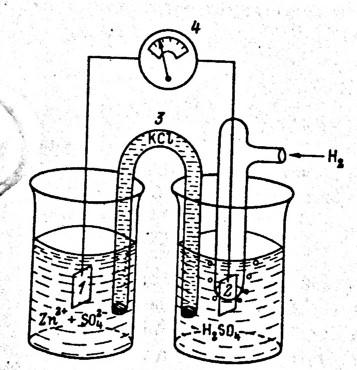
В первый сосуд, с раствором соли цинка опущен кусок металлического цинка, это – цинковый электрод(конц.=1, t=298К, P=101кПа - стандартные условия!!!). Во второй сосуд с серной кислотой помещен водородный электрод. Газообразный водород под давление 101кПаподается на металлический электрод из черненой платины. Между растворами помещен электролитический ключ, обеспечивающий проводимость. (трубка с раствором электролита KCl). Если соединить металлические части электродов проводником, то цепь будет замкнута, и е получат возможность переходить по проводнику от цинка к платине. В стакане с цинковым электродом пойдет процесс окисление цинка, а в стакане с водородным электродом – восстановление протонов водорода. Наш гальванический элемент будет давать ток. Цинк –катод, водородный электрод – анод. Разность потенциалов может быть измерена вольтметром. Разность потенциаловподобных элементов можно использовать в качестве меры окислительной способности окислителя и восстановительной способности восстановителя в растворах. Правда, для этого необходимо проводить измерение при стандартных условиях, не изменяющихся во времени. Этого можно добиться приложив навстречу ЭДС элемента равное напряжение от внешнего источника тока.
Таким образом, мы можем измерить значения разности стандартных потенциалов любых электродов, которые можно реализовать на опыте, но не можем измерить потенциалы отдельных электродов. Для преодоления этого измерения было решено условно приянть за 0 потенциал стандартного водородного электрода, а разность потенциалов любого другого электрода и водорода рассматривать как характеристику окислительной способности данного окислителя. За меру окислительной способности окислителя принят его стандартный восстановительный потенциал – стандартный потенциал электрода, включающий пару окислитель-восстановитель, по отношению у стандартному водородному электроду.
Стандартный электродный потенциал:
Разность потенциалов, измеряемая при погружении металла в раствор собственного иона с активной концентрацией 1 моль/л относительно стандартного водородного электрода, потенциал которого при 25 С условно принимается равным нулю, называется стандартным электродным потенциалом данного металла E (СЭП)
Каждой полуреакции восстановления соответсвует свой стандартный восстановительный потенциал, значения которого можно найти в специальных таблицах.
Факторы, влияющие на электродный потенциал:
-природа веществ - частников электродного процесса
-концентрации растворов, в которые погружены электроды
-температура системы
-реакции комплексообразования (Обычно наиболее склонна к реакциям комплексообразования окисленная форма, в результате чего потенциал системы и окислительные свойства уменьшаются)
Зависимость электродного потенциала от этих факторов выражается уравнение Нернста
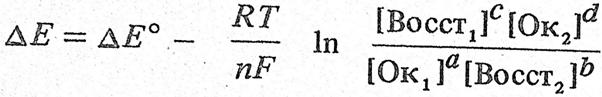
оно же п приведенном виде
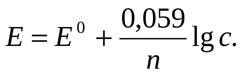
25.Германий, олово, свинец: электронная конфигурация атомов. Степени окисления. Отношение к кислотам и щелочам. α- и β-оловянные кислоты. Гидроксокомплексы. Окислительные свойства соединений свинца(IV). Свинцовый сурик.
Германий.
Получают из побочных продуктов различных производств. из них выделяю концентрат, подвергают его гидролизу и полученный диоксид восстанавливают водородом.
GeO2+2H2=Ge+2H2O
GeO2+2C=Ge+2CO
Электронная конфигурация: 3d104s24p2
Степени окисления: -4 +1 +2 +3 +4 (устойчивые -4, +2, +4)
Отношение к кислотам и щелочам.
При стандартных условиях ни кислоты, ни щелеочи не действуют на него. Даже с концентрированными щелочами он реагирует лишь в присутствии сильных окислителей, образуя гидроксокомплексы:
Ge+2NaOH+2H2O2=Na2[Ge(OH)6]
Также германий способен при нагревании растворяться в концентрированных кислотах-окислителях с образованием катионных форм:
Ge+4H2SO4=Ge(SO4)2+2SO2+4H2O
Подобно олову, германий дает соединения, в которых он находится в степени окисления+2, такие, как GeO2, GeCl2 и некоторые другие.
Простые германаты сильно гидролизованы в растворе. Германиевая кислота склонна образовывать коллоидные системы, а в твердом состоянии существует в виде GeO2*nH2O. Она несколько растворима в воде, ее растворы имеют кислую реакцию и заметную электропроводимость.
3Ge+12HCl+4HNO3=3GeCl4+4NO+8H2O
GeO2+4HCl=GeCl4+2H2O
GeO2+2NAOH=NA2GeO3=H2O
GEO2+CO=GEO+CO2
GEO2+6HF=H2[GEF6]+2H2O
GEO2+4NAOH(ПЛАВЛЕНИЕ)=NA4GEO4+2H2O
GE(OH)2+2KOH конц = K2[GE(OH)4]
Олово (Sn)
Получают восстанавливая из окидов углем
Электронная конфигурация: 4d105s25p2
Степени окисления: -4, +2, +4
У олова есть возможность делокализации е с образованием металлической связи. При низких температурах устойчиво альфа-олово, имеющее алмазную решетку. При 13 градусах цельсия происходит переход альфа-структуры в структуру металла с искаженной плотной кубической упаковкой – ветта-олово, при этом плотность возрастает.
Для О. характерны соединения, в которых он находится в степенях +2 и +4. В химическом отношении ведет себя как малоактивный амфотерный Ме. На холоду реагирует с галогенами, но окисляется кислородом. Медленно растворяется в разбавленных кислотах с образованием солей Sn2+ и выделение кислорода. Конц. Серная и азотная кислоты окисляют олово до SnO2. При нагревании олово растворяется в щелочах с образованием станнитов – гидроксокомплексов олова(2), которые в присутсвии окислителей переходят в соединения олово(4)
SnO2+6HCl=H2[SNCL6]+2H2O
SnO2+2NAOH=NA2SNO3+H2O
альфа-Sn-серое олово, бетта-олово — белое
2SnO=SnO2+Sn
Sn+4HNO3конц=бетта-H2SNO3+4NO2+H2O
SNo2+2cl2+2C=SNCL4+2CO
альфа-оловяннаяH4SNO4+6HCL=H2[SNCL6]+4H2O
H4SNO4+2NAOH=NA2[SN(OH)6]
бетта-H2SNO3+2NAOH=NA2SNO3+2H2O
бетта-H2SNO3+2K2S2O7=SN(SO4)2+2K2SO4+H2O
SNO2+2NAOH=NA2SNO3+H2O
Sn+2KOH+2H2O=K2[Sn9OH04]+H2
Sn+2KOH+2H2O2=K2[Sn(OH)6]
K2[Sn9OH04]+H2O2=K2[Sn(OH)6]
Sn(OH)2+NaOH=Na[Sn(OH)3]
Оловянная кислота, а точнее, высокогидратированный диокисд Sn2O*H2O может быть получен в виде активной формы, растворимой в активных щелочах и кислотах – так называемой альфа-оловянной кислоты – осаждением из щелочных растворовпри действии кислот. Окисление олова конц азотной к-той дает малорастворимый осадок ветта-оловянной к-ты. Альфа-и бетта-формы отличаются дисперсностью и содержанием воды.
Состояние олово(4) в водных растворах лучше всего передается формулой [Sn(OH)x(H2O)6-x]4-xЮ где 0<х<6 и его значение определяется величиной pH: чем больше пш раствора, тем больше х.
Свинец (Pb)
Получают восстанавливая из окидов углем, защищает от радиации
Электронная конфигурация: 4f145d106s26p2
Степени окисления: -4, +2, +4
Представляет собой типичный Ме с плотной кубической упаковкой частиц в структуре.
Большинство солей Pb(+2), в частности PbCl2 и PbSO4, малорастворимо, поэтому свинец плохо растворяется в HCl и H2SO4 и при стандартных условиях взаимодействует только с азотной к-той.
PbO2 – сильный окислитель: 3PbO2+4H2S=3PbS+4H2O+SO2
Свинцовый сурик – это смешанный оксид свинца(2) и (4) Pb2O3. Он легко получается при окислении PbO2 кислородом при 500градуах цельсия в виде яркого красно-оранщевого порошка. Сурик применяется как чрезвычайно стойкий краситель, в частности для окраски подводной части судов.
Гидроксопроизводные в воде нерастворимы. Диоксид свинца инертен, и соответствующие ему гидратированные формы неизвестны. Он растворяется в изб. Конц. Щелочей, и из таких растворов могут быть выделены гексагидроксоплюмбаты(4) K2[Pb(OH)6]
Pbo2+6hcl=h2[pbcl4]+cl2+2h2o ПРИ ТЕМПЕРАТУРА>0
PBO2+4HCL=PBCL4+2H2O ПРИ МЕНЬШЕ НУЛЯ
PBO2+2NAOH+2H2O=NA2[PB(OH)6]
2PBO2=2PBO+O2
2PBO2+4H2SO4=2H2[PB(SO4)2]+O2+2H2O
PBO2+2KOH+2H2O=K2[PB(OH)6]
PB3O4-СВИНЦОВЫЙ СУРИК, степень окисления +2 и +4
3PBO2=PB3O4+O2
PB3O4+4HNO3=PBO2+2PB(NO3)2+2H2O
PB3O4+8CH3COOH=PB(CH3COO)4+2PB(CH3OO)2+4H2O
26. Фосфорноватистая и фосфористая кислоты, их
получение. Строение молекул, основ- ность. Окислительно-восстановительные свойства гипофосфитов и фосфитов.
Фосфорноватистая кислота Н3РО2
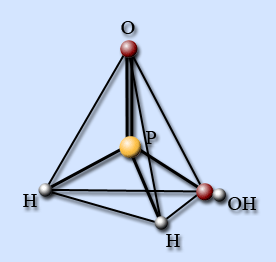
Молекула имеет форму тетраэдра с атомом фосфора в центре, в вершинах тетраэдра находятся два атома водорода, атом кислорода и гидроксогруппа. Поэтому фосфористая кислота, несмотря на наличие трех атомов водорода, является одноосновной.
Фосфорноватистая кислота – это белые кристаллы, хорошо растворимые в воде и в органических растворителях. Температура плавления 27 °С.
Одноосновная кислота средней силы. Очень сильный восстановитель:
5H3PO2 + 4KMnO4 + 6H2SO4 = 5H3PO4 + 4MnSO4 + 2K2SO4 + 6H2O.
При температуре около 50 °С разлагается:
3H3PO2 = PH3 + 2H3PO3.
Соли – гипофосфиты. Практически все хорошо растворимы в воде, соли переходных металлов мгновенно разлагаются.
Получение. При диспропорционировании белого фосфора в концентрированной щелочи образуется гипофосфит – соль фосфорноватистой кислоты, раствор кислоты легко получается действием серной кислоты на гипофосфит:
2P4 + 3Ba(OH)2 + 6H2O = PH3 + 3Ba(H2PO2)2;
Ba(H2PO2)2 + H2SO4 = 2H3PO2 + BaSO4.
Фосфористая кислота
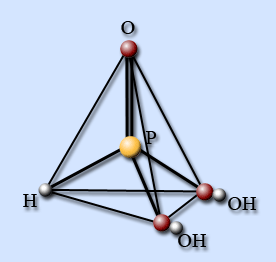
Молекула имеет форму тетраэдра с атомом фосфора в центре, в вершинах тетраэдра находятся атом водорода, атом кислорода и две гидроксогруппы. Поэтому фосфористая кислота, несмотря на наличие трех атомов водорода, является двухосновной.
Фосфористая кислота – это бесцветные кристаллы, хорошо растворимые в воде и спирте, температура плавления 74 °С, температура разложения 197 °С.
Двухосновная кислота средней силы. Является хорошим восстановителем, хотя и менее сильным, чем фосфорноватистая кислота, она также обесцвечивает раствор перманганата калия:
5H3PO3 + 2KMnO4 + 3H2SO4 = 5H3PO4 + 2MnSO4 + K2SO4 + 3H2O.
При нагревании до 200 °С разлагается:
4H3PO3 = PH3 + 3H3PO4.
Соли – фосфиты и гидрофосфиты. Практически все хорошо растворимы в воде, соли переходных металлов разлагаются: при незначительном нагревании:
Ag2HPO3 = 2Ag + HPO3.
Получение
Образуется при гидролизе трихлорида фосфора:
PCl3 + 3H2O = H3PO3 + 3HCl.
ОВ свойства гиппофосфитов и фосфитов:
Гипофосфиты (Н3РО2фосфорноватистая+КОН=КН2РО2)– сильные восстановители, окисляются до фосфатов:
NiCl2 + NaH2PO2 + 2H2O = Ni + Na3PO4 + 4HCl + H2, используется для никелирования поверхностей
Получение:
P4+Ba(OH)2=PH3+Ba(H2PO2)+H2SO4=BaSO4+H3PO2
соединения фосфора (1) практически не проявляют окислительных свойств, но при нагревании они диспропорционируют: 3 H3PO2 = H3P + 2 H3PO3
Соединения фосфора (3) – фосфиты - довольно сильные восстановители (переходят в фосфаты). Они, например, восстанавливают малоактивные металлы из растворов их соединений:
HgCl2 + H3PO3 + H2O = H3PO4 + Hg + 2HCl
2AgNO3+NA2HPO3+H2O=H3PO4+2AG+NANO3
Получение: PCl3+3H2O=H3PO3+3HCl
27. Равновесия в растворах комплексных соединений. Константы нестойкости – общая и ступенчатые, их взаимосвязь. Кислотные свойства аквакомплексов.
Растворам комплексных соединений, относящихся к электролитам, свойственны динамические ионные равновесия, характерные для электролитов, т.е. комп.соед. в растворах подвержены в значительной степени первичной электролитической диссоциации. Не изменяющиеся в конц. растворе компл.соли при разбавлении ведут себя так же, как и простые соли, т.е. распадаются на ионы. Например K2[PtCl4]=2K(+)+[PtCl4](-)
Для компл. Ионов характерно наличие в растворах сольватационных равновесий следующего типа:
[PtCl4](-)+H2O=[PtCl3(H2O)](-)+Cl(-)
[PtCl3(H2O)](-)+H2O=[PtCl2(H2O)2]+Cl(-)
В результате подобных сальватационных процессов, вызываемых обменными реакциями комплексных ионов с молекулами растворителя, возникают гидратированные ионы соответствующих элементов и в растворе появляются «вымытые» из комплекса молекулы или ионы.
Сольватационное равновесие комплекса вызывает в ряде случаев равновесие кислотно-основного типа.
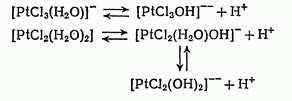
Подобно ступенчатой диссоциаци электролитов, первые ступени сальватационного равновесия и отвечающего ему кислотно-основного равновесия более резко выражены чем последующие.
В противоположность ионным и кисл-осн равновесиям, устанавливающимся практически моментально, сольватационные равновесия устанавливаются со временем.
Комплексные ионы в растворах подвергаются также, но в меньшей степени, вторичной эл.дисс. Вторичную эл.дисс. комплексов обычно рассматривают вне связи с сольватационными процессами и изображают в виде простых уравнений эл.дисс.
|
|
28.Аммиак, промышленный и лабораторный способы получения. Строение молекулы; химические свойства. Амиды, имиды и нитриды металлов.
Аммиа́к — NH3, нитрид водорода, при нормальных условиях — бесцветный газ с резким характерным запахом почти вдвое легче воздуха, ядовит. Растворимость NH3 в воде чрезвычайно велика — около 1200 объёмов (при 0 °C)
Промышленный способ получения аммиака основан на прямом взаимодействии водорода и азота:
N2(г) + 3H2(г) ↔ 2NH3(г) + 45,9
Для получения аммиака в лаборатории используют действие сильных щелочей на соли аммония:
NH4Cl + NaOH = NH3↑ + NaCl + H2O.
В природе аммиак образуется при разложении азотсодержащих органических веществ
l Благодаря наличию неподеленной электронной пары во многих реакциях аммиак выступает как нуклеофил или комплексообразователь. Так, он присоединяет протон, образуя ион аммония:
NH3 + H+ → NH4+
l Водный раствор аммиака имеет слабощелочную реакцию из-за протекания процесса:
NH3 + H2O → NH4+ + OH−; Ko=1,8 · 10−5
l Взаимодействуя с кислотами даёт соответствующие соли аммония:
NH3 + HNO3 → NH4NO3
l Аммиак также является очень слабой кислотой, способен образовывать с металлами соли. Соединения, содержащие ионы NH2−, называются амидами, NH2− — имидами, а N3− — нитридами
l При нагревании аммиак проявляет восстановительные свойства. Так, он горит в атмосфере кислорода, образуя воду и азот. Окисление аммиака воздухом на платиновом катализаторе даёт оксиды азота, что используется в промышленности для получения азотной кислоты:
4NH3 + 3O2 → 2N2 + 6H20
4NH3 + 5O2 → 4NO + 6H2O
На восстановительной способности NH3 основано применение нашатыря NH4Cl для очистки поверхности металла от оксидов при их пайке:
3CuO + 2NH4Cl → 3Cu + 3H2O +2HCl + N2
Окисляя аммиак гипохлоритом натрия в присутствии желатина, получают гидразин:
2NH3 + NaClO → N2H4 + NaCl + H2O
l Галогены (хлор, йод) образуют с аммиаком опасные взрывчатые вещества — галогениды азота (хлористый азот, иодистый азот).
l С карбоновыми кислотами, их ангидридами, галогенангидридами, эфирами и другими производными даёт амиды. С альдегидами и кетонами — основания Шиффа, которые возможно восстановить до соответствующих аминов (восстановительное аминирование).
l При 1000 °C аммиак реагирует с углём, образуя HCN и частично разлагаясь на азот и водород. Также он может реагировать с метаном, образуя ту же самую синильную кислоту:
CH4 + NH3 + 1,5O2 → HCN + 3H2O
Амиды металлов MeNH2 образуются при взаимодействии активных металлов с аммиаком. Так, амид натрия NaNH2 получают пропусканием газообразного аммиака над расплавленным натрием:
2NH3 + 2Na = 2NaNH2 + Н2
Амиды являются аналогами гидроксидов. Амиды подвергаются в водных растворах необратимому гидролизу:
KNH2 + H2O → NaOH + NH3
Амиды нейтрализуются кислотами.
KNH2 + 2HCl = KCl + NH4Cl
Подобно водным растворам щелочей, аммиачные растворы амидов хорошо проводят электрический ток, что обусловлено диссоциацией:
MNH2 → M+ + NH2−
Фенолфталеин в этих растворах окрашивается в красный цвет, при добавлении кислот происходит их нейтрализация.
2Li3N+6H2O=6LIOH+2NH3
BN+3H2O=H3BO3+NH3
NH4CL+3CL2=CL3N+4HCL
CL3N+3H2O=2HCLO+NH4CLO
2NH3+6NA=2NA3N+3H2
NH3+2NA=NA2NH+H2(ИМИД)
ZN3N2+6H2O=2NH3+3ZN(OH)2
GeCl4+6NH3=GE(NH)2+4NH4CL
GE(NH)2+2H2O=GEO2+2NH3
2GE(NH)2=(GEN)2NH+NH3
29. Соединения благородных газов, их получение и свойства.
Гелий
Гелий — наименее химически активный элемент восьмой группы таблицы Менделеева (инертные газы). Многие соединения гелия существуют только в газовой фазе в виде так называемых эксимерных молекул, у которых устойчивы возбуждённые электронные состояния и неустойчиво основное состояние. Гелий образует двухатомные молекулы He2, фторид HeF, хлорид HeCl (эксимерные молекулы образуются при действии электрического разряда или ультрафиолетового излучения на смесь гелия с фтором или хлором).
Получение
В промышленности гелий получают из гелийсодержащих природных газов (в настоящее время эксплуатируются главным образом месторождения, содержащие > 0,1 % гелия). От других газов гелий отделяют методом глубокого охлаждения, используя то, что он сжижается труднее всех остальных газов. Охлаждение производят дросселированием в несколько стадий очищая его от CO2 и углеводородов. В результате получается смесь гелия, неона и водорода. Эту смесь, т.н. сырой гелий, (He - 70-90 % об.) очищают от водорода (4-5 %) с помощью CuO при 650—800 К. Окончательная очистка достигается охлаждением оставшейся смеси кипящим под вакуумом N2 и адсорбцией примесей на активном угле в адсорберах, также охлаждаемых жидким N2. Производят гелий технической чистоты (99,80 % по объёму гелий) и высокой чистоты (99,985 %).
Неон
Все благородные газы имеют завершенную электронную оболочку, поэтому они химически инертны. Химическая инертность неона исключительна, в этом с ним может конкурировать только гелий. Пока не получено ни одного его валентного соединения. Даже так называемые клатратные соединения неона с водой (Ne·6Н2О), гидрохиноном и другими веществами (подобные соединения тяжелых благородных газов — радона, ксенона, криптона и даже аргона — широко известны) получить и сохранить очень трудно.
Однако, с помощью методов оптической спектроскопии и масс-спектрометрии установлено существование ионов Ne+, (NeAr)+, (NeH)+, и (HeNe)+.
Аргон
Получение- ретивикация воздуха с получение кислорода, азота и попцтным извлечением аргона
Аргон - одноатомный газ без цвета и запаха
Природный аргон состоит из изотопов с мас. ч. 36 (0,337% по объему), 38 (0,063%), 40 (99,600%), т.е., в отличие от др. легких элементов, преобладает самый тяжелый изотоп. Причина этого -концентрирование 40Аг в атмосфере в результате распада в литосфере 40К
С водой, фенолом, гидрохиноном и ацетоном аргон образует соед. включения, а с электроотрицат. атомами в электрич. разряде или под действием пучка электронов - эксимеры
Аргон используют в кач-ве защитной среды при сварке (60-65% получаемого аргона), получении металлов и в др. металлургич. процессах (30-35%), в произ-ве полупроводниковых материалов, при хим. синтезах. Аргон применяют также как наполнитель в светотехнике (в разрядных трубках, люминесцентных лампах; 2-3%), электронике (в тиратронах и др.), ядерной технике (в ионизац. счетчиках и др.)
Соединение CU(Ar)O получено из соединения урана с углеродом и кислородом CUO[8]. Вероятно существование соединений со связями Ar-Si и Ar-C: FArSiF3 и FarCCH
HarF – ГИДРОФТОРИД
разлагается при низких температурах на HF и Ar
Криптон
Криптон- одноатомный газ без цвета и запаха
Прир. криптон, выделенный из воздуха, состоит из изотопов 78Кr (0,354% по объему), 80Kr (2,27%), 82Kr (11,56%), 83Kr (11,55%), 84Кr (56,90%), 86Kr (17,37%)
Известны эксимерные соединения., например. KrF*, KrСl*, KrВr*, КrO*, применяемые в УФ лазерах. Из хим. соед. криптона получены только криптона дифторид KrF2 и его производные, напр.: KrF+ SbF-6, Kr2Р3+AuF6-, KrF+Та2F11-
Применение. Используют криптон для наполнения ламп накаливания, газоразрядных и рентгеновских трубок. Радиоактивный изотоп 85Kr используют как источник b-излучения в медицине, для обнаружения течей в вакуумных установках, как изотопный индикатор при исследованиях коррозии, для контроля износа деталей..
2KrF2+2H2O=2Kr+4HF+O2
2Au+5KrF2=2AuF5+5Kr
Ксенон
Соединения с валентными связями Э (II), Э (IV), Э (VI), Э (VIII) хорошо изучены на примере фторидов Kr и Xe, полученных по схеме
| Xe+nF2=XeF2, XeF4, XeF6, XeF8 |
Химическая связь в соединениях благородных газов не может быть описана с позиций МВС, поскольку в соответствии с этим методом в образовании связи должны участвовать d-орбитали. Однако возбуждение одного электрона с p- на d-орбиталь требует для ксенона около 100 кДж/атом, что не компенсируется энергией образования связи.
В рамках ММО строение XeF2 объясняется схемой, в которой d-орбитали не участвуют:
тетрафторид ксенона является сильным окислителем:
Pt+ XeF4+HF=H2[PtF6]
4KI+XeF4=Xe+2I2=4KF
При нагревании и гидролизе XeF4 диспропорционирует:
Для шестивалентного Xe известны фторид XeF6, оксид XeO3, XeOF4 – оксофторид, XeO3 хорошо растворим в воде и образует сильную кислоту H2XeO4
Для Xe (VIII) известны, кроме того, XeF8, XeO4, XeOF6
В обычных условиях XeO4 медленно разлагается:
3XeO4=Xe=2XeO3+O2
Xe+PtF6=Xe[PtF6]
Xe+F2=XeF2
Xe+2F2=XeF4
2XeF2+2H2O=2Xe+4HF+O2
XeF4+H2O=XeOF2+2HF(низкая t)
6XeF4+12H2O=4Xe+3O2+2XeO3+24HF
5XeO3+6MnSO4+9H2O=5Xe+6HMnO4+6H2SO4
3XeO3+O3+12NaOH=3Na4XeO6+6H2O
Ba2XeO6+2H2SO4=2BAaSO4+XeO4+2H2O
3XeO4=2XeO3+Xe+3O2
LiXeO6=2Li2O+Xe+2O2
ПОЛУЧЕНИЕ ТРИОКСИДА КСЕНОНА
2XeF6+SiO2=2XeOF4+SiF4
2XeOF4+SiO2=2XeO2F2+SiF4
2XeO2F2+SiO2=2XeO3+SiF4
30.Электролитическая диссоциация воды, ионное произведение воды, зависимость
величины Кw от температуры. Водородный показатель.
Вода представляет собой слабый амфотерный электролит:
Н2О Н+ + ОН-
или, более точно:
2Н2О Н3О+ + ОН-
Константа диссоциации воды при 25оС равна:
KД=[H+][OH-]/[H2O]=1.86e-16
Такое значение константы соответствует диссоциации одной из ста миллионов молекул воды, поэтому концентрацию воды можно считать постоянной и равной 55,55 моль/л (плотность воды 1000 г/л, масса 1 л 1000 г, количество вещества воды 1000г:18г/моль=55,55 моль, С=55,55 моль: 1 л =55,55 моль/л). Тогда
[H+][OH-]= KД*[H2O]=1.86*10-16*55.55=10-14
Эта величина постоянная при данной температуре (25оС), она называется ионным произведением воды KW
Kw= [H+][OH-]=10-14
Константа Kв, равная произведению концентраций протонов и гидроксид-ионов, называется ионным произведением воды. Она является постоянной не только для чистой воды, но также и для разбавленных водных растворов веществ. C повышением температуры диссоциация воды увеличивается, следовательно, растёт и Kв, при понижении температуры — наоборот.
Водоро́дный показа́тель, pH — мера активности ионов водорода в растворе, и количественно выражающая его кислотность,
pH=7 среда нейтральная
pH>7 Щелочная
pH< 7 Кислая
Вода, хотя и является слабым электролитом, в небольшой степени диссоциирует:
H2O + H2O ↔ H3O+ + OH−илиH2O ↔ H+ + OH−
Равновесие этой реакции сильно смещено влево. Константу диссоциации воды можно вычислить по формуле:
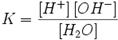
где:
[H+] — концентрация ионов гидроксония (протонов);
[OH−] — концентрация гидроксид-ионов;
[H2O] — концентрация воды (в молекулярной форме) в воде;
Концентрация воды в воде, учитывая её малую степень диссоциации, величина практически постоянная и составляет (1000 г/л)/(18 г/моль) = 55,56 моль/л.
При 25 °C константа диссоциации воды равна 1,8Ч10−16моль/л. Уравнение (1) можно переписать как: 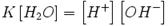 Обозначим произведение K·[H2O] = Kв = 1,8Ч10−16 моль/л·55,56 моль/л = 10−14мольІ/лІ = [H+]·[OH−] (при 25 °C).
Обозначим произведение K·[H2O] = Kв = 1,8Ч10−16 моль/л·55,56 моль/л = 10−14мольІ/лІ = [H+]·[OH−] (при 25 °C).
Константа Kв, равная произведению концентраций протонов и гидроксид-ионов, называется ионным произведением воды. Она является постоянной не только для чистой воды, но также и для разбавленных водных растворов веществ. C повышением температуры диссоциация воды увеличивается, следовательно, растёт и Kв, при понижении температуры — наоборот. Практическое значение ионного произведения воды
Практическое значение ионного произведения воды велико, так как оно позволяет при известной кислотности (щёлочности) любого раствора (то есть при известной концентрации [H+] или [OH−]) найти соответственно концентрации [OH−] или [H+]. Хотя в большинстве случаев для удобства представления пользуются не абсолютными значениями концентраций, а взятыми с обратными знаком их десятичными логарифмами — соответственно, водородным показателем (pH) и гидроксильным показателем (pOH).
31. Оксиды азота: солеобразующие и несолеобразующие. Азотная и азотистая кислоты, их
кислотные и окислительные свойства. Окислительно-восстановительная двойствен-
ность нитритов.
Оксид азота(I) (оксид диазота, закись азота, веселящий газ) — соединение с химической формулой N2O. При нормальной температуре это бесцветный негорючий газ с приятным сладковатым запахом и привкусом. Иногда называется «веселящим газом» из-за производимого им опьяняющего эффекта.
Получение
Закись азота получают нагреванием сухого нитрата аммония. Разложение начинается при 170 °C и сопровождается выделением тепла. Поэтому, чтобы не дать протекать ему слишком бурно, следует вовремя прекратить нагревание, так как при температурах более 300 °C нитрат аммония разлагается со взрывом:
NH4NO3 → N2O↑ + 2H2O.
Более удобным способом является нагревание сульфаминовой кислоты с 73%-й азотной кислотой:
NH2SO2OH + HNO3 (73 %) → N2O↑ + SO2(OH)2 + H2O.
Относится к несолеобразующим оксидам. В нормальных условиях N2O химически инертен, при нагревании проявляет свойства окислителя:
N2O + H2 → N2↑ + H2O;
N2O + C → N2↑ + CO↑.
При взаимодействии с сильными окислителями N2O может проявлять свойства восстановителя:
5N2О + 8KMnO4 + 7H2SO4 → 5Mn(NO3)2 + 3MnSO4 + 4K2SO4 + 7H2O.
При нагревании N2O разлагается:
2N2O → 2N2↑ + O2↑.
Оксид азота(II) (мон(о)оксид азота, окись азота,) несолеобразующий оксид азота. Он представляет собой бесцветный газ, плохо растворимый в воде. Сжижается с трудом; в жидком и твёрдом виде имеет голубой цвет.
Получение
Оксид азота(II) — единственный из оксидов азота, который можно получить непосредственно из свободных элементов соединением азота с кислородом при высоких температурах (1200—1300 °C) или в электрическом разряде. В природе он образуется в атмосфере при грозовых разрядах:
N2 + O2 → 2NO — 180,9 кДж
и тотчас же реагирует с кислородом:
2NO + O2 → 2NO2.
При понижении температуры оксид азота(II) разлагается на азот и кислород, но если температура падает резко, то не успевший разложиться оксид существует достаточно долго: при низкой температуре скорость распада невелика. Такое резкое охлаждение называется «закалкой» и используется при одном из способов получения азотной кислоты.
В лаборатории его обычно получают взаимодействием 30%-ной HNO3 с некоторыми металлами, например, с медью:
3Cu + 8HNO3 (30 %) → 3Cu(NO3)2 + 2NO↑ + 4H2O.
Более чистый, не загрязнённый примесями NO можно получить по реакциям:
FeCl2 + NaNO2 + 2HCl → FeCl3 + NaCl + NO↑ + H2O;
2HNO2 + 2HI → 2NO↑ + I2↓ + 2H2O.
Промышленный способ основан на окислении аммиака при высокой температуре и давлении при участии Pt, Cr2O3 (как катализаторов):
4NH3 + 5O2 → 4NO + 6H2O.
При комнатной температуре и атмосферном давлении окисление NO кислородом воздуха происходит мгновенно:
2NO + O2 → 2NO2
Для NO характерны также реакции присоединения галогенов с образованием нитрозилгалогенидов, в этой реакции NO проявляет свойства восстановителя:
2NO + Cl2 → 2NOCl (нитрозилхлорид).
В присутствии более сильных восстановителей NO проявляет окислительные свойства:
2SO2 + 2NO → 2SO3 + N2↑.
В воде NO мало растворим и с ней не реагирует, являясь несолеобразующим оксидом.
оксид азота(III) (азотистый ангидрид, сесквиоксид азота) N2O3 — бесцветный газ (при н. у.), в твёрдом виде — синеватого цвета. Устойчив только при температурах ниже −4 °C. Без примесей NO2 и NO существует только в твёрдом виде.
Получение
Рекомендуется капать 50%-ю азотную кислоту на твёрдый оксид мышьяка(III):
2HNO3 (50 %) + As2O3 → NO2↑ + NO↑ + HAsO3.
N2O3 образуется при охлаждении получающейся смеси газов.
При пропускании электрического разряда через жидкий воздух N2O3 можно получить в виде порошка голубого цвета:
N2 + O2 → 2NO;
2NO + O2 → 2NO2;
NO + NO2 → N2O3.
Также N2O3 можно получить действием 50%-ой азотной кислоты на крахмал.
Химические свойства
Кислотный оксид. N2O3 подвержен термической диссоциации:
N2O3 ↔ NO2 + NO.
При 25 °C содержание N2O3 в смеси газов составляет около 10,5 %. Жидкий оксид азота(III) синего цвета, он также частично диссоциирован.
Являясь азотистым ангидридом, при взаимодействии с водой N2O3 даёт азотистую кислоту:
N2O3 + H2O ↔ 2HNO2.
При взаимодействии с растворами щелочей образуются соответствующие нитриты:
N2O3 + 2KOH → 2KNO2 + H2O.
Оксид азота (IV) (диоксид азота, бурый газ, лисий хвост) NO2 — газ, красно-бурого цвета, с характерным острым запахом.
Получение
В лаборатории NO2 обычно получают воздействием концентрированной азотной кислотой на медь:
Cu + 4HNO3 (конц.) → Cu(NO3)2 + 2NO2↑ + 2H2O.
Также его можно получить термическим разложением нитрата свинца, однако при проведении реакции следует соблюдать осторожность:
2Pb(NO3)2 → 2PbO + 4NO2↑ + O2↑.
Химические свойства
Кислотный оксид, ему соответствуют азотная и азотистая кислоты. NO2 отличается высокой химической активностью. Он взаимодействует с неметаллами (фосфор, сера и углерод горят в нём). В этих реакциях NO2 — окислитель:
2NO2 + 2C → 2CO2↑ + N2↑;
10NO2 + 8P → 4P2O5 + 5N2↑ (10NO2 + 2P4 → 2P4O10 + 5N2↑);
Окисляет SO2 в SO3 — на этой реакции основан нитрозный метод получения серной кислоты:
SO2 + NO2 → SO3 + NO↑.
При растворении оксида азота(IV) в воде образуются азотная и азотистая кислоты (реакция диспропорционирования):
2NO2 + H2O ↔ HNO3 + HNO2.
Поскольку азотистая кислота неустойчива, при растворении NO2 в тёплой воде образуются HNO3 и NO:
3NO2 + H2O → 2HNO3 + NO↑.
Если растворение проводить в избытке кислорода, образуется только азотная кислота (NO2 проявляет свойства восстановителя):
4NO2 + 2H2O + O2 ↔ 4HNO3.
При растворении NO2 в щелочах образуются как нитраты, так и нитриты:
2NO2 + 2KOH → KNO3 + KNO2 + H2O.
Жидкий NO2 применяется для получения безводных нитратов:
Zn + 2N2O4 -> Zn(NO3)2 + 2NO
Оксид азота(V) (пентаоксид диазота, азотный ангидрид) N2O5 — бесцветные, очень летучие кристаллы. Крайне неустойчив.
Получение
1) Путём дегидратации азотной кислоты HNO3 посредством P2O5:
2HNO3 + P2O5 → 2HPO3 + N2O5;
12HNO3 + P4O10 → 4H3PO4 + 6N2O5;
2) Пропуская сухой хлор над сухим нитратом серебра:
4AgNO3 + 2Cl2 → 4AgCl + 2N2O5 + O2↑(по другим данным, тут будет образовываться хлорид серебра и хлорнитрат);
3) Путём взаимодействием оксида азота(IV) с озоном:
2NO2 + O3 → N2O5 + O2↑.
Свойства
Типичный кислотный оксид. N2O5 легко летуч и крайне неустойчив. Разложение происходит со взрывом, чаще всего — без видимых причин:
2N2O5 → 4NO2↑ + O2↑ + Q.
Растворяется в воде с образованием азотной кислоты (обратимая реакция):
N2O5 + H2O ↔ 2HNO3.
Растворяется в щелочах с образованием нитратов:
N2O5 + 2NaOH → 2NaNO3 + H2O.
Азотная кислота:
Химические свойства
Высококонцентрированная HNO3 имеет обычно бурую окраску вследствие происходящего на свету процесса разложения:
При нагревании азотная кислота распадается по той же реакции. Азотную кислоту можно перегонять (без разложения) только при пониженном давлении (указанная температура кипения при атмосферном давлении найдена экстраполяцией).
Золото, некоторые металлы платиновой группы и тантал инертны к азотной кислоте во всём диапазоне концентраций, остальные металлы реагируют с ней, ход реакции при этом определяется её концентрацией. HNO3 как сильная одноосновная кислота взаимодействует:
а) с основными и амфотерными оксидами:
CuO + 2HNO3 = Cu(NO3)2 + H2O
ZnO + 2HNO3 = Zn(NO3)2 + H2O
б) с основаниями:
KOH + HNO3 = KNO3 + H2O
в) вытесняет слабые кислоты из их солей:
При кипении или под действием света азотная кислота частично разлагается:
Азотная кислота в любой концентрации проявляет свойства кислоты-окислителя, при этом азот восстанавливается до степени окисления от +4 до -3. Глубина восстановления зависит в первую очередь от природы восстановителя и от концентрации азотной кислоты. Как кислота-окислитель, HNO3 взаимодействует:
а) с металлами, стоящими в ряду напряжений правее водорода:
Концентрированная HNO3
Разбавленная HNO3
б) с металлами, стоящими в ряду напряжений левее водорода:
4Zn + 10HNO3(3%) = 4Zn(NO3)2 + NH4NO3 + 3H2O
Все приведенные выше уравнения отражают только доминирующий ход реакции. Это означает, что в данных условиях продуктов данной реакции больше, чем продуктов других реакций, например, при взаимодействии цинка с азотной кислотой (массовая доля азотной кислоты в растворе 0,3) в продуктах будет содержаться больше всего NO, но также будут содержаться (только в меньших количествах) и NO2, N2O, N2 и NH4NO3.
Единственная общая закономерность при взаимодействии азотной кислоты с металлами: чем более разбавленная кислота и чем активнее металл, тем глубже восстанавливается азот:
увеличение активности металла
>
NO2 NO N2O N2 NH4NO3
>
уменьшение концентрации кислоты С золотом и платиной азотная кислота, даже концентрированная не взаимодействует. Железо, алюминий, хром концентрированной азотной кислотой пассивируются. С разбавленной азотной кислотой железо взаимодействует, причем в зависимости от концентрации кислоты образуются не только различные продукты восстановления азота, но и различные продукты окисления железа:
4Fe + 10HNO3(2%) = Fe(NO3)2 + NH4NO3 + 3H2O
Азотная кислота окисляет неметаллы, при этом азот обычно восстанавливается до NO или NO2:
и сложные вещества, например:
3FeS + 14HNO3(30%) = 3Fe(NO3)3 + 6S + 5NO + 7H2O
Некоторые органические соединения (например амины и гидразин, скипидар) самовоспламеняются при контакте с концентрированной азотной кислотой.
Некоторые металлы (железо, хром, алюминий), реагирующие с разбавленной азотной кислотой, пассивируются концентрированной азотной кислотой и устойчивы к её воздействию.
Смесь азотной и серной кислот носит название «меланж».
Азотная кислота широко используется для получения нитросоединений.
Смесь трех объёмов соляной кислотой и одного объёма азотной называется «царской водкой». Царская водка растворяет большинство металлов, в том числе золото и платину. Её сильные окислительные способности обусловлены образующимся атомарным хлором и хлоридом нитрозила:
Азотистая кислота
N2O3+H2O=2HNO2
Химические свойства
В водных растворах существует равновесие:
2HNO2 ↔ N2O3 + H2O ↔ NO↑ + NO2↑ + H2O
При нагревании раствора азотистая кислота распадается с выделением NO и NO2:
3HNO2 ↔ HNO3 + 2NO↑ + H2O.
HNO2 в водных растворах диссоциирует (KD=4,6·10-4), немного сильнее уксусной кислоты. Легко вытесняется более сильными кислотами из солей:
H2SO4 + NaNO2 → NaHSO4 + HNO2.
Азотистая кислота проявляет как окислительные, так и восстановительные свойства. При действии более сильных окислителей (Н2О2, КМnО4) окисляется в HNO3:
2HNO2 + 2HI → 2NO↑ + I2↓ + 2H2O;
5HNO2 + 2HMnO4 → 2Mn(NO3)2 + HNO3 + 3H2O;
HNO2 + Cl2 + H2O → HNO3
 2018-01-21
2018-01-21 5330
5330

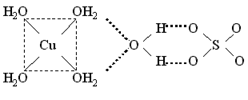
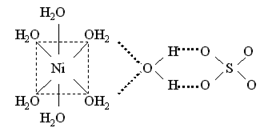 Координационные формулы указанных соединений, учитывающие состав внутренней и внешней сферы, таковы: · [Cu(H2O)4]SO4.H2O и · [Ni(H2O)6]SO4.H2O. Все аквакатионы, за исключением тех, которые образованы щелочными и щелочноземельными элементами, а также таллием(I), серебром(I) и т.п., являются катионными кислотами, в водном растворе подвергаются протолизу и создают кислотную среду (рН < 7): [Zn(H2O)4]2++ H2O
Координационные формулы указанных соединений, учитывающие состав внутренней и внешней сферы, таковы: · [Cu(H2O)4]SO4.H2O и · [Ni(H2O)6]SO4.H2O. Все аквакатионы, за исключением тех, которые образованы щелочными и щелочноземельными элементами, а также таллием(I), серебром(I) и т.п., являются катионными кислотами, в водном растворе подвергаются протолизу и создают кислотную среду (рН < 7): [Zn(H2O)4]2++ H2O 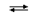 [Zn(H2O)3(OH)]++ H3O+ Кислотные свойства аквакомплексов выражены тем сильнее, чем выше степень окисления атома-комплексообразователя. железа(III) составляют 1,8.10-7 и 6,8.10-3. Следовательно, равновесие протолиза в случае аквакомплекса железа(III) в большей степени смещено вправо, чем для железа(II).
[Zn(H2O)3(OH)]++ H3O+ Кислотные свойства аквакомплексов выражены тем сильнее, чем выше степень окисления атома-комплексообразователя. железа(III) составляют 1,8.10-7 и 6,8.10-3. Следовательно, равновесие протолиза в случае аквакомплекса железа(III) в большей степени смещено вправо, чем для железа(II). 






