Рассмотрим образование химических связей в молекуле ВеF2:

В образовании связей участвуют 2s- и 2рх-орбитали возбужденного атома бериллия (рис. 8, а), которые должны перекрываться с соответствующими 2р-орбиталями атомов фтора. Из характера перекрывания следует, что связь, образованная 2рх-орбиталью бериллия, должна быть более прочной, чем связь, образованная его 2s-орбиталью. Направление образования первой связи строго определенное – вдоль оси х. Перекрывание 2s-орбитали не имеет преимущества в каком-либо направлении, поэтому угол между связями в молекуле ВеF2 может быть переменным.
Л.Полинг и Дж.Слейтер разработали теорию гибридизации: близкие по энергии валентные орбитали с различной симметрией преобразуются в такое же количество одинаковых гибридных орбиталей, каждая из которых представляет собой продукт смешения исходных орбиталей. Гибридные орбитали более вытянуты в направлении образования химической связи и обеспечивают лучшее перекрывание.
В нашем примере в гибридизации участвуют одна 2s- и одна 2р-орбиталь атома бериллия. Такой случай называется sp-гибридизацией. Гибридные орбитали представляют собой линейные комбинации исходных атомных орбиталей с учетом знаков их частей – «лопастей»

sp-Гибридизация характерна для элементов II группы, но возможна и для атомов других элементов, образующих две s-связи с участием одной s- и одной р-орбиталей.
Участие в образовании связей одной s- и двух р-орбиталей центрального атома приводит к sp2-гибридизации. Гибридизация такого типа характерна для соединений элементов III группы.
Рассмотрим ее на примере молекулы ВF3. В возбужденном атоме бора при образовании связей происходит гибридизация трех орбиталей – 2s, 2рх, 2рz:

(Здесь у двух атомов фтора показаны только 2р-электроны, образующие связи.) Три гибридные орбитали (sp2)g в соответствии с принципом наименьшей энергии ориентируются так, чтобы отталкивание между ними было минимальным. Этому отвечают углы между осями гибридных орбиталей, равные 120° (рис. 11). Поэтому молекула ВF3 – плоская, связи в ней – равноценные, направленные по углам правильного треугольника.

Рис. 11. sp2-Гибридизация: а – исходные 2s-, 2рx- и 2рz-орбитали; б – гибридные 2(sp2)g—орбитали
sp3-Гибридизация, в которой участвуют s-орбиталь и все три p-орбитали, характерна для соединений элементов IV группы периодической системы, в частности для насыщенных углеводородов. Рассмотрим молекулу метана СН4.

В этом случае (при sp3-гибридизации) образуются четыре sp3-гибридные орбитали, направленные в пространстве по углам тетраэдра. Углы между осями гибридных орбиталей составляют 109,46° (рис. 12). Рассмотренный ранее ион аммония NH4+ также имеет тетраэдрическое строение благодаря sp3-гибридизации.
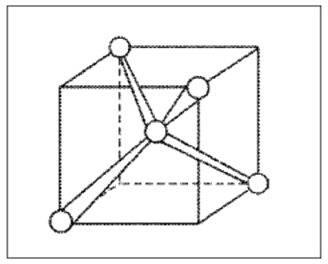
Рис. 12. Ориентация sp3-гибридных орбиталей в молекуле СН4
В гибридизации могут участвовать и d-орбитали внешнего или предвнешнего квантового уровня. При образовании комплексного иона [АlF6]3– происходит sp3d2-гибридизация, в которой участвуют вакантные d-орбитали:

Такие шесть гибридных орбиталей направлены по углам октаэдра. Угол между связями 90° (рис. 13).

Рис. 13. Ориентация sp3d2- и d2sp3-гибридных орбиталей
В комплексном ионе [Fе(СN)6]4– в гибридизации участвуют «внутренние» d-орбитали предвнешнего квантового слоя. При возбуждении иона Fе2+, входящего в состав комплекса, происходит спаривание 3d-электронов и переход в гибридное валентное состояние:

Связи образуются в результате взаимодействия вакантных гибридных d2sp3-орбиталей иона *Feg 2+и не-поделенных пар электронов шести ионов СN–. Тип гибридизации – d2sp3. Геометрическая форма комплекса также октаэдрическая.
Гибридизация с участием d-орбиталей дает и другие структуры молекул и сложных ионов.
Таким образом, направленность валентности обусловлена ориентацией гибридных орбиталей в пространстве. В обобщенной форме это представлено в табл. 2.
 2018-01-21
2018-01-21 2450
2450
