
Молекула должна иметь пирамидальную форму: в вершине пирамиды – атом азота, угол между связями – 90°. Однако экспериментально измеренный угол составляет ~107,8°, что значительно лучше согласуется с тетраэдрической конфигурацией, характерной для sp3-гибридизации. Это можно объяснить, если предположить, что в гибридизации принимает участие орбиталь неподеленной (несвязывающей) пары электронов:
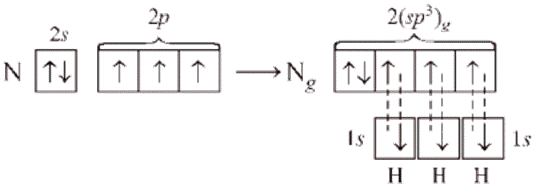
Перекрывание орбиталей в молекуле NH3 показано на рис. 14.
 Участие в гибридизации орбиталей неподеленных пар электронов, не образующих связей, называют явлением полной гибридизации.
Участие в гибридизации орбиталей неподеленных пар электронов, не образующих связей, называют явлением полной гибридизации.
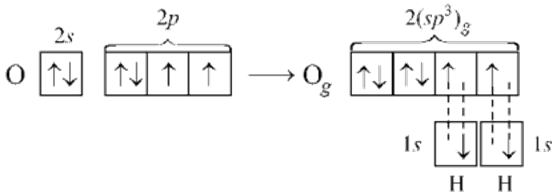
С этих же позиций участием орбиталей двух неподеленных пар электронов в sp3-гибридизации можно объяснить строение молекулы воды, в которой угол между связями О–Н равен ~104,5°:
46.Фосфор, нахождение в природе. Электронная конфигурация атома в основном и валентно-возбуждённом состоянии. Получение элементарного фосфора. Отношение фосфора к кислотам и щелочам. Фосфины.
Распространение Фосфора в природе. Среднее содержание Фосфора в земной коре (кларк) - 9,3·10-2% по массе; в средних горных породах 1,6·10-1, в основных породах 1,4·10-1, меньше в гранитах и других кислых изверженных породах - 7·10-2 и еще меньше в ультраосновных породах (мантии) - 1,7·102%; в осадочных горных породах от 1,7·10-2 (песчаники) до 4·10-2% (карбонатные породы). Фосфор принимает участие в магматических процессах и энергично мигрирует в биосфере. С обоими процессами связаны его крупные накопления, образующие промышленные месторождения апатитов и фосфоритов. Фосфор - исключительно важный биогенный элемент, он накапливается многими организмами. С биогенной миграцией связаны многие процессы концентрации Фосфора в земной коре. Из вод Фосфор легко осаждается в виде нерастворимых минералов или захватывается живым веществом. Поэтому в морской воде лишь 7·10-6% Фосфора. Известно около 180 минералов Фосфора, в основном - это различные фосфаты, из которых наиболее распространены фосфаты кальция.
Электронная конфигурация фосфора:[Ne] 3s2 3p3, в возбужд состоянии [Ne]3s1 3p3 3d1 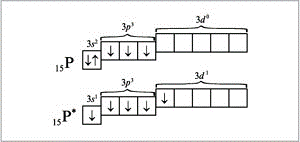
Получение: Фосфор получают из апатитов или фосфоритов в результате взаимодействия с коксом и кремнезёмом при температуре около 1600 °С:
Са3(РО4)2 + 5С + 3SiO2 = 2P + 5СО + 3СаSiO3
Ca3(PO4)2+3SI2=3CASIO3+P2O5
P2O5+5C=2P+5CO
Образующиеся пары фосфора конденсируются в приёмнике под слоем воды в аллотропическую модификацию в виде белого фосфора. Вместо фосфоритов для получения элементарного фосфора можно восстанавливать углём и другие неорганические соединения фосфора, например, в том числе, метафосфорную кислоту: 4HPO4+10C=P4+2H2O+10CO
Отношение фосфора к кислотам и щелочам:
1. P+H2SO4=H3PO4+SO2(c р-й не реагирует)
2. 3P+5HNO3(k)+2H2O=3H3PO4+5NO
3. Ba(OH)2 + P= PH3 + Ba(H2PO2)2 +H2O
4. Окисление Р при поджигании спичек 6Р+5KClO3=5KCl+3P2O5
Фосфины(очень много, надо сокращать?): соед. фосфора с водородом. Фосфин (фосфористый водород) PH3 - бесцв. газ с резким запахом гнилой рыбы; конфигурация молекулы - тригон. пирамида; образует кристаллы с гранецентрир. кубич. решеткой. Раств. в бензоле, диэти-ловом эфире, CS2. Умеренно раств. в воде, причем, в р-ре устанавливается равновесие: 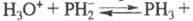
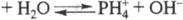 . Ион фосфония PH+4 малоустойчив. Самая устойчивая соль фосфония (в твердом состоянии) - иодид PH4I.Водой и щелочными р-рами соли фосфония разлагаются с выделением PH3.
. Ион фосфония PH+4 малоустойчив. Самая устойчивая соль фосфония (в твердом состоянии) - иодид PH4I.Водой и щелочными р-рами соли фосфония разлагаются с выделением PH3.
PH3 и соли фосфония - сильные восстановители. При нагр. PH3 разлагается, на воздухе выше 100 0C воспламеняется, в присут. небольших кол-в P2H4 самовозгорается, в смеси с O2 взрывается. В щелочных р-рах окислит.-восстановит. потенциал PH3 -1,12 В (PH3 + 5OH- - 4е  H2PO-2 + 3H2O). PH3 восстанавливает ионы мн. металлов из р-ров их солей.
H2PO-2 + 3H2O). PH3 восстанавливает ионы мн. металлов из р-ров их солей.
Получают PH3 взаимод. фосфидов (напр., Cu3P2) с водой или к-той; наряду с PH3 образуются небольшие кол-ва P2H4. Его синтезируют также р-цией белого P с р-ром щелочи при нагр., взаимод. KOH с PH4I в водном р-ре. PH3 образуется при получении белого и красного P; при действии к-т на фосфиды металлов (напр., при травлении сталей, содержащих заметную примесь P); при использовании цианамида Ca, загрязненного Ca3(PO4)2, и ацетилена, полученного из фосфорсодержащего карбида (содержание PH3 в C2H2 иногда достигает 0,02-0,06%); при применении вместо извести карбидных отходов от получения ацетилена. Используют PH3 для синтеза фосфорорг. соед., для получения фосфора особой чистоты (2PH3+ 2PCl3  4Р + 6НС1). Токсичен, действует преим. на нервную систему, нарушает обмен в-в и др.; многочасовое воздействие может привести к смерти.
4Р + 6НС1). Токсичен, действует преим. на нервную систему, нарушает обмен в-в и др.; многочасовое воздействие может привести к смерти.
Дифосфин P2H4 - бесцв. летучая жидкость;не обладает основными св-вами, не реагирует с к-тами. Сильный восстановитель, на воздухе самовоспламеняется, при нагр. и хранении на свету разлагается. В продуктах распада присутствуют P, PH3 и аморфное в-во желтого цвета (твердый фосфористый водород), представляющее собой низшие гидриды фосфора PxHy., где x > у, напр. P2H, P5H2, P9H2, P12H6. Это в-во раств. только в дифосфине и расплавленном P, при обычных условиях устойчиво; восстановитель.
Ca3P2+6H2O=3CA(OH)2+2PH3
PH3+2O2==HPO3+H2O
PH3+HI=PH4I
PH3+8AGNO3+4H2O=8AG+H3PO4+8HNO3
47. Фтор. Нахождение в природе. Получение в промышленных и лабораторных условиях. Соединения фтора и их свойства. Гидрофториды.
Фтор — химически активный неметалл и самый сильный окислитель. При н.у. - двухатомный газ (формула F2).
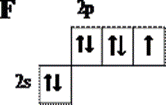
Нахождение в природе: в минерале флюорите (CaF2) плавиковый шпат.
Получение в промышленности: электролизом расплава кислого фторида калия KF•2HF
2KHF2=(электролиз) Н2 + F2 + 2KF
Встречается в виде малорастворимых солей апатита, топаза, полевого шпата
Получение в лабораторных условиях:
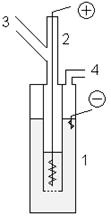
1) электролизом: В лабораторных условиях фтор можно получать с помощью показанной установки. В медный сосуд 1, заполненный расплавом KF·3HF, помещают медный сосуд 2, имеющий отверстия в дне. В сосуд 2 помещают толстый никелевый анод. Катод помещается в сосуд 1. Таким образом, в процессе электролиза газообразный фтор выделяется из трубки 3, а водород — из трубки 4. Важным требованием является обеспечение герметичности системы, для этого используют пробки из фторида кальция со смазкой из оксида свинца (II) и глицерина.
2) Метод Карла Кристе: 2K2MnF6 + 4SbF5 = 4KSbF6 + 2MnF3 + F2↑
(данный метод не имеет практического применения)
3)можно использовать нагрев фторида кобальта (III) до 300 °С
2CoF3=2CoF2+F2
4)разложение фторидов серебра (слишком дорого)
Соединения фтора и их свойства:
СaF2 - фтористый кальций или флюорит
Свойства: а) при высокой температуре подвергается гидролизу
CaF2 + H2O = CaO + 2HF
б) разлагается концентрированной серной кислотой
СaF2 + H2SO4 = CaSO4 + 2HF↑
в)при избытке HF образует сложный кристаллогидрат:
CaF2 + 2HF + 6H2O = Ca(HF2)2 * 6H2O
MeBF4⁻ - фторбораты
Свойства:а) фторбораты металлов разлагаются при нагреве по реакции:
MeBF4 = MeF + BF3
б) получение
H(BF4) + MeCO3 = Me(BF4) + CO2 + H2O
HSO3F - Фторсульфо́новая кислота́ (очень сильная кислота, растворяет многие фториды металлов).
2F2+2H2O=4HF+O2
5F2+CL2=2CLF5
SiO2+2F2=SiF4+O2
2NO2+F2=2NO2F
Ca+ F2= CaF2,
2. С неметаллами (Р, S):
S + 3F2= SF6,
2P + 5F2 = 2PF5.
1. С азотом и кислородом напрямую фтор не реагирует.
2. От водородных соединений фтор отнимает протон:
F2+ H2O = 2HF + Q,
F2+H2O=HOF+HF
HOF+H2O=HF+H2O2
Фтористый кислород может быть получен по реакции:
2F2+ 2NaOH = 2NaF + H2O + F2O.
 2018-01-21
2018-01-21 6693
6693








