1. От водородных соединений фтор отнимает протон.
F2+ H2O = 2HF + Q,
2. Получение фтористого кислорода:
2F2+ 2NaOH = 2NaF + H2O + F2O
3. Взаимодействие с водородом, хлором:
H2+ 2+ F2= 2HF (взрыв),
Cl2+ F2 = 2ClF.
CaF2+H2SO4=2HF+CaSO4
HNO3+HF=H2NO3+ +F-
SiO2+4HF=SiF4+2H2O
HOF+2NaOH=NaF+NaHO2+H2O
3BrF3+6H2O=2HBrO3+9HF+HBr
Se+3BrF5=SeF6+3BrF3
Гидрофториды: это соединения, содержащие в качестве аниона HF₂⁻.
Получение гидрофторидов: (Me-металл)
-MeF + HF = MeHF₂
-MeOH + 2HF = MeHF2 + H2O
-MeCO3 + HF = KHF2 + CO2
Разложение:
-MeHF2 =(нагревание)MeF + HF↑
-MeHF2 + H2SO4 =(нагревание)MeSO4 + HF↑
-MeHF2 + MeOH = MeF + H2O
48.Характеристики ковалентной химической связи: энергия, длина, кратность, поляр- ность.
Ковалентная связь - это химическая связь, возникающая за счет увеличения электронной плотности в области между химически связанными атомами.Связывающие электроны находятся преимущественно в пространстве между связываемыми атомами. За счет притяжения ядер атомов к этим электронам образуется химическая связь.
Энергия ковалентной химической связи - это энергия, которую нужно затратить, чтобы разъединить атомы и удалить их друг от друга на расстояние, на котором они не взаимодействуют. Или энергия, которая выделяется при разрыве химической связи. Чем выше энергия химической связи, тем прочнее связь.
Длина ковалентной химической связи - это межъядерное расстояние между химически связанными атомами. Чем выше кратность связи, тем короче межатомное расстояние.
Кратность ковалентной химической связи - число электронных пар, обобществлённых двумя соседними атомами молекулы в результате ковалентной химической связи. Определяется количеством электронных пар, связывающих два атома.
Полярность ковалентной химической связи - характеристика химической связи, показывающая изменение распределения электронной плотности в пространстве вокруг ядер в сравнении с распределением электронной плотности в образующих данную связь нейтральных атомах. Чем выше значение разности электроотрицательностей двух атомов, тем более полярной является химическая связь между ними. Полярная ковалентная связь образуется между любыми атомами, имеющими разные значения электроотрицательности.охарактеризовать полярность связи можно на основе измерения дипольного момента:
μ = q r,
где q − заряд полюса диполя, равный для двухатомной молекулы эффективному заряду, r − межъядерное расстояние.
49. Углерод. Электронная конфигурация атома. Оксиды углерода, их получение и свойства. Карбонилы металлов. Угольная кислота. Карбонаты и гидрокарбонаты, реакции гидролиза.
Углерод - неметаллический химический элемент IVA подгруппы (C, Si, Ge, Sn, Pb) периодической системы элементов. Встречается в природе в виде кристаллов алмаза, графита или фуллерена и других форм и входит в состав органических (уголь, нефть, организмы животных и растений и др.) и неорганических веществ (известняк, пищевая сода и др.)
Электронная конфигурация атома углерода: ls² 2s² 2p²
Оксиды углерода: СO и CO2
1)СO - монооксид углерода или угарный газ: C=O. Восстановитель, лиганд, токсичный.
Получение: 2С+О2=2СО
C+H2O(пар) = CO+H2
Свойства: PdCl2+CO+H2O = Pd+CO2+2HCL
Fe2O3+3CO = 2Fe+3CO2
CO+Cl2 = COCl(фосген)
CO+S=COS (оксосульфид углерода IV)
CO+O2=CO2
2)CO2 - диоксид углерода или углекислый газ: (плохо растворим в воде)
Получение в промышленности: CaCO3 =(обжиг известняка) CaO+CO2
Получение в лаборатории: CaCO3+2HC l= CaCl2+CO2+H2O
Свойства: 2Mg + CO2 = 2MgO + C
СO2+Na2O = Na2CO3
CO2 + H2O ↔ H2CO3
Ca(OH)2 + CO2 = CaCO3↓ + H2O (качественная реакция на углекислый газ)
KOH + CO2 → KHCO3
Координационные соединения с диоксидом углерода распространены меньше, чем с СО.
Карбонилы металлов - химические соединения, координационные комплексы монооксида углерода СО с переходными металлами общей формулой MeCO.
Fe(тв)+5CO(газ) = [Fe(CO)5]
Атом металла в карбониле находится в нулевой степени окисления. Общий способ получения карбонилов: восстановление соединений металлов в присутствии СО. Группы СО в карбонилах металлов могут замещаться на др. лиганды (L) фосфины, фосфиты, амины, изонитрилы, непредельные органические соединения и др., например: Сr(СО)6 + L →[Cr(L)(CO)5] + CO;
При нагревании с НNО3 или H2SO4 дают соответствующие соли. При взаимодействии с галогенами образуются карбонилгалогениды (Me(CO)Hal) или галогениды металлов. Многие карбонилы металлов легко окисляются на воздухе. Карбонилы металлов реагируют с щелочными металлами или с их гидроксидами.
Fe(CO)5 + NaOH → Na[Fe(CO)4CO2H]
Угольная кислота:
Угольная кислота - слабая двухосновная кислота, неустойчива.
CO2+H2O = H2CO3
Угольная кислота вступает в реакции нейтрализации с растворами оснований, образуя средние и кислые соли:
H2CO3+NaOH(конц.) = Na2CO3+H2O
H2CO3+NaOH(разб.) = NaHCO3+H2O
При взаимодействии угольной кислоты с карбонатами образуются гидрокарбонаты:
H2CO3+Na2CO3=2NaHCO3
Карбонаты и гидрокарбонаты:
При нагревании кислые карбонаты переходят в нормальные карбонаты: 2NaHCO3=Na2CO3+H2O+CO2
При сильном нагревании нормальные карбонаты разлагаются на оксиды и углекислый газ:
Na2CO3=Na2O+CO2
Карбонаты реагируют с кислотами сильнее угольной:
Na2CO3+2HCl=2NaCl+H2O+CO2
Реакции гидролиза:
Гидролиз по первой ступени:
Na2CO3+H2O=NaOH+NaHCO3
2Na(+)+CO3(2-)+H2O=2Na(+)+OH(-)+HCO3(-)
CO3(2-)+H2O=OH(-)+HCO3(-)
Гидролиз по второй ступени:
NaHCO3+H2O=NaOH+H2CO3
Na(+)+HCO3(-)+H2O↔Na(+)+OH(-)+H2CO3
HCO3(-)+H2O↔OH(-)+H2CO3
50.Химические свойства разбавленной и концентрированной азотной кислоты. Царская водка и ее действие на золото и платину.
Концентрированная HNO3
-С Fe, Cr, Al, Au, Pt, Ir, Na не взаимодействует по причине образования на их поверхности защитной плёнки, которая не позволяет дальше окисляться металлу.
-С активными металлами 1А и 2А группы и с Mg
10HNO3 + 4Mg = 4Mg(NO3)2 + N2O +5H2O
-C неактивными металлами
4НNO3 + Zn = Zn(NO3)2 + 2NO2 + 2H2O
-С неметаллами
5HNO3 конц. + P = H3PO4 + 5NO2 + H2O
Разбавленная HNO3
-C металлами 1А и 2А группы = NH4NO3 или NH3
-C металлами средней активности = N2
-С неактивными металлами = NО

Царская водка: HNO + 3HCl
Cмесь концентрированных азотной HNO3 и соляной HCl кислот, взятых в соотношении 1:3 по объёму. Жидкость жёлто-оранжевого цвета с сильным запахом хлора и диоксида азота.
Действие царской водки на золото и платину:
Царская водка растворяет золото и платину уже при комнатной температуре Au + 4HCl + HNO3 = H(AuCl4) + NO↑ + 2H2O
3Pt + 18HCl + 4HNO3 = 3H2(PtCl6) + 4NO↑ + 8H2O
51.Ионные реакции в растворах. Молекулярнно-ионые формы уравнений. Константы равновесия ионных реакций.
Наиболее распространенными и многообразными являются в растворе реакции обмена. К обменным реакциям в растворах относится, в частности, взаимодействие между кислотами и основаниями, в результате которого образуются соль и вода. Такие реакции называются реакциями нейтрализации. Нейтрализация доходит до конца только тогда, когда единственным малодиссоциированным веществом в системе является вода, например:
НС1 + КОН = КС1 + Н2О
В ионно-молекулярном виде:
Н+ + С1- +К+ + ОН- = К+ + С1- + Н2О
В сокращенном виде Н+ + ОН- = Н2О
Н 0нейтр = -56 
Доказательством того, что реакция нейтрализации сильных кислот сильными основаниями сводятся к образованию воды из ионов гидроксония и гидроксила, служит одинаковой тепловой эффект этих реакций в пересчете на 1 моль нейтрализующейся воды
Н 0нейтр = -56 
В этой системе из 4х веществ только одно (Н2О) малодиссоциированно, а все остальные - сильные электролиты.
Взаимная нейтрализация кислот и оснований, отличающихся друг от друга по силе, до конца не протекает.
Например:
СН3СООН + КОН СН3СООК + Н2О
СН3СООН + К+ + ОН- СН3СОО- + К+ + Н2О
СН3СООН + ОН- СН3СОО- + Н2О
Эта реакция нейтрализации обратима. Обратная реакция нейтрализации, т.е. реакция взаимодействия кислоты и основания называется реакцией гидролиза.
Гидролизом соли называется - взаимодействие ионов соли с водой, приводящее к образованию слабого электролита и к изменению рН среды. Гидролиз – является частным случаем сольволиза – обменного разложения растворенного вещества и растворителя.
1. Гидролиз по аниону – соль образована слабой одноосновной кислотой и сильным основанием.
СН3СООNa + H2O ↔ СН3СООН + NaOH
СН3СОО- + Na+ + H2O ↔ СН3СООН + Na+ + OH- - избыток ионов OH- - обусловливает щелочную реакцию раствора
СН3СОО- + H2O ↔ СН3СООН + OH- pH > 7
Применим к обратимому процессу з.д.м.:

концентрация воды в растворе постоянна ([H2O]=const),поэтому объединим ее с Кравн. и назовем Кг.- константой гидролиза.
Гидролиз протекает по аниону, т.к. ацетат - ион взаимодействуя с Н+ воды, образует молекулу слабодиссоциирующей уксусной кислоты.
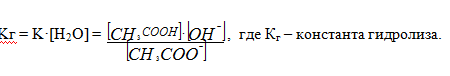

Где Ккисл. – константа диссоциации слабой кислоты, образованной в результате гидролиза соли, тогда
Кг = Kв/Кк
Гидролиз количественно характеризуется степенью гидролизаh, под которой понимают отношение числа молекул, подвергшихся гидролизу, к общему числу растворенных молекул.
Пусть в рассматриваемой реакции гидролиза начальная концентрация соли, а значит и ацетат - ионов (соль - сильный электролит и полностью диссоциирует на ионы) равна с, а степень гидролиза h.
. h = - отношение концентрации соли, подвергшейся гидролизу к общей концентрации соли в растворе.
h = 
1) h увеличивается при уменьшении концентрации соли.
2) h – зависит от силы кислоты, чем меньше Кк , чем слабее кислота, тем в большей степени гидролизуется ее соль.
3) h – зависит от температуры, т.к. Кв – сильно зависит от t, а Кк зависит от t в меньшей степени.
б) Гидролиз по аниону солей двух и многоосновных слабых кислот протекает ступенчато (как процесс обратный ступенчатой диссоциации). Гидролиз протекает главным образом по 1й ступени. И лишь при условиях усиливающих гидролиз – при сильном разбавлении и нагревании следует учитывать гидролиз образовавшейся кислой соли. Так гидролиз карбоната натрия можно записать
I ступень
1) молекулярное уравнение
Na2CО3 + НОН NaHCO3 + Na+ + OH-
2) молекулярно- ионное уравнение
2Na+ +CО2-3 + НОН Na++HCO3 + Na+ + OH-
3) сокращенное ионно-молекулярное уравнение
СО2-3 + НОННСО-3 + ОН- гидролиз идет по аниону
Кг(1) =КH2O/К2HCO3-
II ступень
NaНСО3 + НОНNaOH + H2CO3
Na++ НСО-3 + НОНNa+ +OH- + H2CO3
НСО-3 + НОН OH- + H2CO3
Кг(2) =КH2O/ Кк(1) = КH2O/КН2СО3
При ступенчатом гидролизе вторая и последующие степени гидролиза выражены менее сильно. Это обусловлено уменьшением константы диссоциации при переходе от К1 и К2, от К2 и К3. Например, поскольку ион HCO3- диссоциирует слабее, чем H2CO3, то он и образуется в первую очередь при гидролизе Na2CO3.
h= - отношение концентрации соли, подвергшейся гидролизу к общей концентрации соли в растворе.
h= 
1) h увеличивается при уменьшении концентрации соли.
2) h – зависит от силы кислоты, чем меньше Кк , чем слабее кислота, тем в большей степени гидролизуется ее соль.
3) h – зависит от температуры, т.к. Кв – сильно зависит от t, а Кк зависит от t в меньшей степени.
2. Гидролиз по катиону - с оль образована слабым основанием и сильной кислотой
а) основание однокислотное:
NH4Cl + HOH ↔ NH4OH + HCl
NH4+ + Cl- + HOH ↔ NH4OH + H+ + Cl-
NH4+ + HOH ↔ NH4OH + H+ рН < 7
Гидролиз идет по катиону - катион связывает гидроксид – ионы, образуя слабый электролит, т.к. в избытке ионы водорода, то среда бутет кислая рН<7
В этом случае
c-ch ch ch
NH4+ + HOH ↔ NH4OH + H+
Kг 
[NH4OH]=ch; [H+] = ch NH4+ = c-ch = c·(1-h)

Кг =  т.е. константа гидролиза соли, образованной слабым основанием и сильной кислотой, равна ионному произведению воды, деленному на К диссоциации слабого основания.
т.е. константа гидролиза соли, образованной слабым основанием и сильной кислотой, равна ионному произведению воды, деленному на К диссоциации слабого основания.
h= 
в) Гидролиз соли по катиону - соль образована слабым многокислотным основанием и сильной кислотой.
А1С13 + НОНА1(ОН)С12 + НС1
А13+ + 3С1- + НОНА1ОН2+ +2С1 + Н+ + С1-
А13+ + НОНА1(ОН)2+ + Н+ рНсреды< 7
Al+3 + HOH ↔ AlOH2+ + H+ Ι ст.
AlCl3 + HOH ↔ AlOHCl2 + HCl
AlOH2+ + HOH ↔ Al(OH)2+ + H+ ΙΙст.
AlOHCl2 + HOH ↔ Al(OH)2Cl + HCl
Al(OH)2+ + HOH ↔ Al(OH)3 + H+ ΙΙΙ ст.
Al(OH)2Cl + HOH ↔ Al(OH)3 + HCl
Гидролиз А1С13. Между А1+3 малым по размеру, но имеющим большой заряд и молекулами воды возникает ион - дипольное взаимодействие. Молекулы воды образуют гидратную оболочку и сами при этом искажаются (деформируются), поэтому уменьшается их прочность и возрастает способность к диссоциации на ионы Н+ и ОН-. Тогда ОН- ионы удерживаются в гидратной оболочке, а катионы Н+ могут уходить в объем раствора.

Гидролиз протекает главным образом по 1й ступени. И лишь при условиях усиливающих гидролиз – при сильном разбавлении и нагревании следует учитывать гидролиз образовавшейся кислой соли.
в) Кислота слабая, основание сильное многокислотное:
Ba(CN)2 + HOH ↔ BaOHCN + HCN
Ba2+ + 2CN- + HOH ↔ BaOH+ + CN- + HCN
CN- + HOH ↔ OH- + HCN pH среды >7
г)Кислота сильная (многоосновная), основание слабое однокислотное
(NH4)2SO4 + HOH ↔ NH4HSO4 + NH4OH
2NH4+ + SO42- + HOH ↔ NH4+ + HSO4- + NH4OH
NH4+ + HOH ↔ NH4OH + H+ рНсреды < 7
3. Гидролиз по катиону и по аниону - соль образована слабым основанием и слабой кислотой.
а) соль образована слабой одноосновной кислотой и слабым однокислотным основанием - гидролиз идет и по катиону, и по аниону, протекает практически до конца (с образованием в промежуточной стадии кислых солей).
NH4CN + HOH = NH4OH + HCN
NH4+ + CN + HOH = NH4OH + HCN рН7;
Гидролиз катиона способствует гидролизу аниона. Для выявления более точно реакции среды, нужно сравнить силу кислоты и основания.
К NH4OH=1,8 * 10-5
К HCN=5,0 * 10-10, К NH4OH > KHCN,
следовательно основание сильнее кислоты, концентрация свободных ионов ОН- в растворе будет выше, чем концентрация ионов Н+, и среда станет слабощелочной.
В случае соли NH4CH3COO, константы диссоциации КNH4OH = КСН3СООН практически одинаковы и равны 1,8 10-5.
Н3СООNH4 + НОНСН3СОН + NH4ОН Кг= 
СН3СОО- + NH-4 + НОНСН3СОН + NH4ОН рН = 7 h= 
Т.к. концентрации ацетат - ионов и ионов аммония в растворе одинаковы, то кислота и основание равны по силе, то реакция среды будет нейтральной.
c-ch c-ch ch ch
СH3COO- + NH4 + HOH ↔ CH3COOH + NH4OH
умножим и числитель и знаменатель на [H+]·[OH-]

б) Соль образована слабым многокислотным основанием и слабой многоосновной кислотой.
А12S3+6HOH = 2AI(OH)+3H2S
Сr2S3+6HOH = 2Сr(OH)3+3H2S
В растворе не накапливаются в избытке ни ионы Н+,, ни ионы ОН-, и гидролиз не останавливается на первых стадиях, а протекает дальше, вплоть до образования конечных продуктов А1(ОН)3 и Н2S, т.е.идет до конца.
Гидролиз некоторых солей, образованных очень слабым основаниями и кислотами, является необратимым, например, гидролиз сульфидов и карбонатов А13+,Сr3+,Fe3+. Эти соединения нельзя получить в водном растворе.
При взаимодействии солей А13+,Сr3+, Fe3+ с растворами сульфидов и карбонатов в осадок выпадают не сульфиды и карбонаты этих катионов, а их гидроксиды.
2AlCl3 + 3Na2S + 6H2O → 2Al(OH)3↓ + 3H2S↑ + 6NaCl
2Al3+ + 3S2- + 6H2O → 2Al(OH)3↓ + 3H2S↑
2CrCl3 + 3Na2CO3 + 3H2O → 2Cr(OH)3↓ + 3CO2↑ + 6NaCl
2Cr3+ + 3CO32- + 3H2O → 2Cr(OH)3↓ + 3CO2↑
В рассмотренных примерах происходит взаимное усиление гидролиза двух солей (А1С13 и Nа2S или СrC13 и Na2CO3) и реакция идет до конца.
Это примеры совместного гидролиза – когда продукты гидролиза одной соли взаимодействуют с продуктами гидролиза другой соли, образуя при этом слабо диссоциирующие соединения и гидролиз обеих солей идет до конца.
Уравнения констант гидролиза служат количественным подтверждением того, что чем слабее кислота (основание), соль которой (которого) подвергается гидролизу, тем полнее про  текает гидролиз.
текает гидролиз.
Кг=
Взаимосвязь степени и константы гидролиза аналогична таковой для степени и константы диссоциации (закон разбавления Оствальда).
С уменьшением концентрации растворов гидролиз усиливается (в соответствии с принципом Ле Шателье).
Т.к. при обратимом гидролизе устанавливается динамическое равновесие, то в соответствии с з.д.м. можно сместить равновесие в ту или иную сторону введением в раствор кислоты или основания. Этим пользуются для усиления или подавления гидролиза.
К дисс. воды увеличивается с повышением температуры в большей степени, чем константы диссоциации продуктов гидролиза – слабых кислот и оснований. Поэтому при нагревании степень гидролиза возрастает h=  .
.
Так как реакция нейтрализации экзотермична, то гидролиз, будучи противоположным ей процессом эндотермичен, поэтому нагревание в соответствии с принципом Ле Шателье вызывает усиление гидролиза
Обменные реакции
В практически необратимых реакциях равновесие сильно смещено в сторону образования продуктов реакции.
Часто встречаются процессы при которых слабые электролиты или малорастворимые соединения входят в число исходных и в число конечных продуктов реакции. Например,
HCN(p) + CH3COO-(p)↔ CH3COOH(p) + CN-(p) (1), ΔG˚=43кДж
NH4OH(p) + H+(p) ↔ H2O(ж) + NH4+(p) (2) ΔG˚= -84кДж
слабые электролиты есть и в левой и в правой части уравнений.
В этих случаях равновесие обратимого процесса смещается в сторону образования вещества, обладающего меньшей Кдиссоц.
В реакции (1) равновесие смещено влево KHCN = 4,9 · 10-10 < KCH3COOH = 1,8 · 10-5, в реакции (2) – сильно сдвинуто вправо (KH2O=1,8 · 10-16 < KNH4OH = 1,8 · 10-5).
Примерами процессов в уравнении реакции которых слева и справа входят труднорастворимые вещества, могут служить:
AgCl(k)↓ + NaI(p) ↔ AgI↓(k) + NaCl(p) (1) ΔG˚= - 54кДж
BaCO3↓(k) + Na2SO4(p) ↔ BaSO4↓(k) + Na2CO3(p) (2) ΔG˚≈ 0
Равновесие смещается в сторону образования менее растворимого соединения. В реакции (1) равновесие смещено вправо, т.к. ПРAgI=1,1·10-16 < ПРAgCl =1,8·
10-10. В реакции (2) равновесие лишь несколько сдвинуто в сторону BaSO4
(ПР BaCO3 = 4,9·10-9 > ПР BaSO4 =1,08·10-10).
Встречаются процессы в уравнениях которых с одной стороны равенства имеется малорастворимое соединение, а с другой стороны – слабый электролит. Так, равновесие в системе
AgCN(k)↓ + H+(p) ↔ HCN(p) + Ag+(p) ΔG˚= - 46кДж
значительно смещено вправо, поскольку ион СN- более прочно связывается в молекулу очень слабого электролита HCN, чем в молекулу малорастворимого вещества AgCN. Поэтому осадок AgCN растворяется при добавлении азотной кислоты.
52.Тиосульфат натрия, получение. Взаимодействие с кислотами; хлорной, бромной и иодной водой; нитратом серебра.
Получают при кипячении раствора сульфита натрия с элементарной серой происходит окислительно-восстановительная реакция: NaSO3+S=Na2S2O3
соединение содержит серу в двух степенях окисления. Имеет тетраэдрическую структуру как сульфат ион, только один из атомов кислорода замещен на серу

Наличие серы -2 и +6 докаазывает реакция разложения тиосульфата серебра
Ag2S2O3 + H2O = Ag2S + H2SO4
Тиосульфаты являтся солями сильной, не выделенной в свободном состоянии тиосерной кислоты. Кислота неустойчива и разлагается в результате окисления-воостановления:
Na2S2O3 + 2HCl = 2NaCl + H2S2O3
H2S2O3 = S + SO2 + H2O
Тиосульфаты щелочных металлов устойчивы, хорошо растворимы и используются в качестве восстановителей. Продукты окисления тиосульфат иона зависят от силы окислителя и его количества. Сильные окислители в недостатке окисляют до серу 2 до серы 0
Na2S2O3 + Br2(недост) H2O = S +Na2So4 + 2HBr
С избытком сильного окислителя тиосульфат ионы окисляются до сульфат ионов
Na2S2O3 + 4Br2 + 5H2O = NaSO4 + H2SO4 +8HBr
Мягкие окислители окисляют до тетратионита
2Na2S2O3 + I2 =Na2S4O6 + 2NaI
Последяя реакция проходит количественно и находит применение в аналитической химии.
Тиосульфат ион принимает участие в обменных рекциях. Тиосульфаты тяжелых металлов малорастворимы и неустойчивы, если металл образует сульфид с низким значением ПР.
2Ag+ + S2O3 2- = Ag2S2O3 (белый осадок)
Быстро темнеет: Ag2S2O3 + H2O = Ag2S + H2SO4
53. Щелочные металлы, их нахождение в природе. Получение. Гидриды, оксиды, перокси- ды, супероксиды иозониды щелочных металлов.
S1 элементы Н, Li, Na, Rb, Cs, Fr
Нахождение в природе:
Н: в воде и органических соединениях СО +1
Li, Na, Rb, Cs, Fr: в природе находятся в виде солей (часто хлориды), в основном хорошо растворимы.!каменная соль
Получение в чистом виде:
Н: из металла – конверсия металла (Na (K) + H2O = H2 + …); электролиз воды
Щелочные металлы: электролиз расплавов металлов
Комплексы
соединение лития [Li(H2O)4] – достаточно крепкий комплекс
{Na+(H2O)m}+ - вода просто окружает, гидратационное число не постоянно
K2[PbCl6] – малорастворимо
Сода NaHCO3
NaCl + NH4HCO3 = NaHCO3 + NH4Cl (крепкие растворы без нагревания; По Сольвэ 1863 г)
По Ле Блану 1791 г:
Na2SO4 + CaCO3 + C = Na2CO3 +CaS + CO2 (Кальцинированная сода, кальцинация – прокаливание)
Гидраты
Щелочные металлы образуют гидраты: Me+H- + H2O = MeOH + H2
AlH3 + NaH = Na[AlH4]
Кислородные соединения
Ме + О2 = Ме2О (оксид только при сгорании лития), Ме2О2 (пероксид), МеО2 (надпероксид), МеО3 (озонид)
Оксиды получаютя в условиях недостатка кислорода
Na2O2 + 2Na = 2Na2O
2NaOH + 2Na = 2Na2O + H2
2NaNO2 + 6Na = Na2O +N2
Типичные основные оксиды
Пероксиды
LiOH*H2O + H2O2 = Li2O2 + 3H2O
M2O2+2CO2=2M2CO3+O2 (способ получения кислорода в космосе)
54.Представления о кислотах и основаниях в водных растворах. Кислоты и основания Аррениуса, Бренстеда–Лоури.
Первая серьезная и последовательная попытка создания теории кислот и оснований принадлежит Аррениусу. По его теории кислотами называются соединения, при диссоциации которых образуются ионы водорода, а основаниями - соединения, при диссоциации которых образуются ионы гидроксила. Реакция между кислотой и основанием (т.е. реакция нейтрализации) приводит к образованию соли и воды: HA+BOH=BA+H2O
Более полно кислотно–основные свойства веществ объясняются протолитической теорией кислот и оснований, разработанной одновременно Бренстедом и Лоури (1923). По этой теории кислоты рассматриваются как вещества, которые теряют протоны, а основания – как вещества, которые их присоединяют. Другими словами, кислота является донором протона, а основание – его акцентором.
Если можно установить переход протона от одного реагента к другому, то тем самым можно распределить между ними роль кислоты и основания. Например,
Н+
NH3 + HCINH4CI, NH3 + H2O NH4 + + OH-
основание кислота основание кислота кислота основание
HF + H2O F- + H3O+
кислота основание
Кислота после потери протона превращается в частицу, которая стремится его принять, т.е. в основание.
Такие пары взаимно превращаемых частиц, подобных HFF-; H3O+ H2O; H2O OH-; NH+4 NH3, называются сопряженными кислотами и основаниями. В приведенных примерах первая частица играет роль кислоты, а сопряженная с ней – роль основания.
Переход протона от кислоты к основанию объясняется разным сродством к протону у этих веществ. Роль основания выполняет тот реагент, у которого оно выше. В ряду NH3 - H2O – HF сродство к протону уменьшается. Поэтому с аммиаком вода выступает в роли кислоты, а с фтороводородом – в роли основания.
Почти одновременно с протолитической теорией Льюисом была создана электронная теория кислот и оснований. По этой теории кислоты определяют как вещества, являющиеся акцепторами, а основания – донорами электронных пар, т.е. кислоты рассматриваются как электрофильные, а основания, как нуклеофильные агенты. Общее свойство кислот и оснований по Льюису и Бренстеду – способность к взаимной нейтрализации с образованием стабильных ковалентно - насыщенных соединений.
Расширением Льюисовской концепции является концепция «жестких и мягких» кислот и оснований Пирсона (ЖМКО). Впервые предложенная Пирсоном, эта концепция стала без каких-либо оснований широко употребляться в научной и учебной литературе. К кислотам были отнесены вообще все частицы, имеющие положительный заряд (вакантные орбитали σ и p-симметрии), например: H+, I+, FeCl3, I2 и т.д., а к основаниям – все частицы, имеющие отрицательный заряд, (либо заполненные орбитали σ и π – симметрии (OH-, SO42-, RNH2, I-, R3P, C6H6 и др.). Деление частиц на жесткие и мягкие производилось по степени поляризуемости.
Т.о. под вывеской новой (неудачной) терминологии предполагались, по существу, хорошо известные поляризационные представления, развитые в 40-х годах нашего столетия Б.В.Некрасовым.
В последнее время эта теория все больше подвергается справедливой критике. Основное его утверждение, что жесткая частица легче реагирует с жесткой, а мягкая с мягкой, не оправдалось во многих случаях.
Из других теорий кислот и оснований отметим теорию сольвосистем, развитую Франклином (1905) и теорию Усановича, который считал, что кислотно-основное взаимодействие сводится к солеобразованию.
Вещество, образующее соль при взаимодействии с кислотой является основанием, а при взаимодействии с основанием – кислотой.
55. Сероводород. Получение. Сероводородная кислота, её кислотные и восстановительные свойства. Применение сероводорода в качественном анализе. Полисульфиды и их окислительные свойства.
Сероводород - H2S – бесцветный газ с резким запахом протухших яиц.
1. Плохо растворим в воде.Токсичен.
2. Молекула сероводорода имеет угловую форму.
3. Молекула полярна.
4. В связи с тем, что сероводород не образует крепких водородных связей, в нормальных условиях сероводород – газ.
Получениe
1)Только для получения небольших количеств особо чистого H2S:
H2+S=H2S
2)Вытеснение сильными кислотами из солей:
FeS + 2HCl = FeCl2 + H2S↑(аппарат Киппа)
3) Гидролитическое разложение некоторых халькогенидов:
P2S5+8H2O=2H3PO4+5H2S
Сероводорода кислота- сильный восстановитель:
l Горят в кислороде(воздуха) до сернистого газа: H2S + 3/2 O2 = SO2(г)+ H2O(г)
l Окисляются галогенами: H2S +3Cl2=SCl4+2HCl
l При недостатке O2 получается свободный халькоген: 2H2S(г)+O2(г)=2H2O(ж)+2S(кр) (используется при получении серы из природных газов,содержащих сероводород)
l взаимодействует с окислителями
3H2S + 4HClO3 = 3 H2SO4 + 4HCl
Н2S + 4Cl2 + 4H2O = H2SO4 + 8HCl
Н2S + 2 FеСl3 = 2 FеСl2 + 2 НСl + S(даж со слабыми)
l вступает в реакции репропорционирования
H2S + SO2 = S + H2O
Кислотные свойства:- взаимодействует со щелочами, образуя кислые и нормальные соли
2NaOH + H2S = Na2S + 2H2O
NaOH + H2S = NaHS + H2O
Сероводородная кислота – слабая, двухосновная.В водном растворе сероводород образует слабую сероводородную кислоту и дает кислую реакцию вследствие диссоциации.
H2S ↔HS- + H+
HS-↔S2- + H+
В качественном анализе: (ТАА)при гидролизе дает H2S,HS(-),S(2-) в зависимости от среды(кач.анализ на Металлы)
Полисульфиды — многосернистые соединения общей формулы Me2S n, например, полисульфид аммония (NH4)2Sn.
В структуре этих соединений имеются цепи атомов —S-S---, как правило,n=2-8(2 самое частое, аналоги пероксидов). Искл: (NH4)2S9
Получение полисульфидов при сплавлении сульфидов с серой.
Na2S + 7S = Na2S8
Обладают окислительными и восстановительными свойствами:
1). (NH4)2S2 + SnS = (NH4)2SnS3
Образование тиосолей.
2) 4FeS2 + 11O2 = 2Fe2O3 + 8SO2 (промышленное получение SO2)
При действии кислот диспропорционируют на серу и сероводород
Na2S2 + 2HCl = 2NaCl + H2S + S
56. Серебро, электронная конфигурация атома, отношение к кислотам. Малорастворимые соли, комплексы серебра(I). Взаимодействие галогенидов серебра с растворами: аммиака, тиосульфата натрия.
Серебро – (Ag)белый тяжелый пластичный металл. Малоактивный (благородный металл).
Чистое серебро очень мягкий, ковкий и пластичный металл. По мягкости и ковкости серебро немного уступает золоту.
Oбладает замечательной отражающей способностью
В природе встречается в виде полиметаллических руд, а также самородно.
С.О.+1,+3
1) высокая устойчивость к окислению,особенно в компактном виде
2) Для перевода в раствор сплавляют с окислителем и щелочью
Электронная конфигурация: 1s22s22p63s23p64s23d84p65s14d10
Не реагирует: с кислородом, водой, разбавленной серной и соляной кислотами
Реагирует: с кислотами-окислителями, с сероводородной кислотой
2Ag + 2H2SO4 (к) = Ag2SO4↓ + SO2↑ + 2H2O – при нагревании
3Ag + 4HNO3 (р) = 3AgNO3 + NO↑ + 2H2O
Ag + 2HNO3 (к) = AgNO3 + NO2↑ + H2O
Прочие свойства серебра:
Ag + FeCl3 = AgCl + FeCl2
Взаимодействие
1) с галогенами 2Ag + Hal2 = 2AgHal↓
для всех кроме фторида на свету идет обратная реакция
2) Не реагирует с царской водкой из-за образования пленки хлорида
Малорастворимые соли серебра: светочувствительны
AgCl; творожный осадок
AgBr; светложелтый
AgI; желтый
Хлорид, бромид и иодид серебра отличаются очень слабой растворимостью в воде и разбавленных кислотах. Их получают действием соответствующих галогенидов натрия или калия на раствор нитрата серебра:
AgNO3+NaCl=AgCl+NaNO3
AgCl легко растворяется в водных растворах цианистого калия, тиосульфата и сульфита натрия, аммиака, концентрированной соляной кислоты и хлоридах:
AgCl + 2CN¯ = Ag(CN3) + Сl¯
AgCl + 2S2O32- = [Ag(S2O3)2]3- + Сl¯
AgCl + 2NH3 = [Ag(NH3)2]+ +Сl¯ + 2H2O(кроме AgI)
Комплексы
Ионы серебра образуют прочные комплексы с целым рядом ионов и молекул (CN¯, S2O32-, SO32-, Сl¯, NH3, CS(NH2)2 и т.д.). Благодаря этому практически нерастворимый в воде
Основные комплексы способность образовывать комплексные соединения с аммиаком, цианидами щелочных металлов и тиосульфатом натрия:
AgCl+2NH3+H2O=[Ag(NH3)2]OH+НСl
AgBr+2KCN=K[Ag(CN)2]+KBr
2Na2S2O3 (избыток)+AgCl=Na3[Ag(S2O3)2]+NaCl
2AgСl + Na2S2O3(недостаток) = Ag2S2O3 +2NaCl
Координационное число 2
57. Понятие об энтальпии и энтропии. Изобарно-изотермический потенциал. Определение направления химической реакции в стандартных условиях.
Тепловой эффект хим.реакции- изменение энергии при изобарном переходе определенного числа молей исходного вещества в соответствующее число молей продуктов реакции, выраженное в единицах тепловой энергии - джоулях.
Тепловой эффект хим.реакции измеряется изменением энтальпии при переходе системы из состояния исходных веществ в состояние продуктов реакции.
Тепловые эффекты реакций,протекающие в прямом и обратном направлении равны по величине и противоположны по знаку.
Фундаментальный закон термохимии Гесса: Тепловой эффект реакции зависит от состояния исходных и конечных веществ и не зависит от числа промежуточных стадий.ΔН=ΔН1 +ΔН2 +ΔН3
Энтропия - мера непорядочности системы.
S=Q/T Вся теплота идет на увеличение беспорядочно,хаотичного движения частиц,те.на увеличении энтропии.
В изолированной системе произвольно могут протекать только такие процессы, которые ведут к росту энтропии.
Изобарно-изотермический потенциал, или энергия Гиббса - это величина, показывающая изменение энергии в ходе химической реакции и дающая таким образом ответ на вопрос о принципиальной возможности протекания химической реакции.
Все три величины связаны уравнением:
ΔG = ΔH – TΔS, где T – абсолютная температура.
Если
ΔG>0 – реакция не может идти в данных условиях
ΔG=0 – реакция может протекать в обоих направлениях
ΔG<0 – реакция МОЖЕТ идти
Стандартные условия: р = 105 Па; T=273 K; C = 1M. В стандартных условиях для вычисления изменения величин используют ΔH°, S°
58. Сера. Электронная конфигурация атома в основном и валентно-возбужденных состояниях. Взаимодействие серы с растворами щелочей; хлорной водой; азотной кислотой (конц.). Галогениды серы.
Сера – халькоген(рождающий руду), неметалл.
Энергетически выгодно образование Sn. Связанные вандервальсовыми силами образует устойчивые формы простых веществ.
Ромбическая. Желтая. Наибольший выигрыш в энергии при образовании молекулы S8: участие перпендикуляр. р-орбиталей-> валентный угол между связями в цепи 90°,форма короны
Моноклинная. При 95,5° из ромбической S.Кристаллы получают при 119,2°с
Пластическая. Плавление при 150°С-> вязкасть расплава увеличивается-> разрыв цепи на короткие фрагменты. Охлаждение. Резиноподобная масса черного цвета,которая в течение нескольких дней совершает перегруппировку цепей-> ромбическая сера
Электронная конфигурация: 3s23p4 с двумя не спаренными р-электронами

с.о.: -2;0;+4;+6
Взаимодействия серы:
3S + 6KOH = K2SO3 + 2K2S + 3H2O – при нагревании
S + 4H2O + 3Cl2 = 6HCl + H2SO4
S + 6HNO3 (к) = H2SO4 + 6NO2 + 2H2O
Галогениды серы:
Галогениды серы образуются в абсолютно безводной среде.
На холоду реагирует с хлором и фтором.
S + 3F2 = SF6
S + 2F2 = SF4
S + Cl2 = SCl2
S2Br2, S2I2 и другие галогениды получают в достаточно жестких условиях.
Галогениды серы подобны галоген-ангидридам. При растворении в воде дают сульфоксиловую и галогеноводородную кислоты.
SHal2 + 2H2O = H2SO2 + 2Hal
59.Марганец, основные степени окисления. Приведите примеры реакций с участием соединений марганца в различных степенях окисления.
Mn – 3d34s2 –элемент побочной подгруппы седьмой группы четвёртого периода. Относится к чёрным металлам, как железо (сам марганец серебристый). В основном его добывают из пиролюзита (MnO2). Марганцу не характерны аммиачные комплексы.
MnO2+C →t Mn + CO
Mn +CO→t Mn2(CO)10
KMnO4 активно используют в качестве окислителя.
Mn2+ в водном растворе (акваион) – розоватый
Основные степени окисления: 0; +2; +4; +6; +7
Mn(OH)2 +O2+H2O→MnO(OH)2;H2MnO3 – марганцовистая кислота
MnO4- +SO3- +H+→Mn2+
MnO4- +SO3- + H2O→MnO2; MnO2+HClк→MnCl2+Cl2+H2O
MnO4- +SO3- +OH-→ MnO42-
MnO2+KNO3+K2CO3→t с; K2MnO4→Эл-лизKMnO4
HMnO4(красная)→Mn2O7+H2O – взрывается при взаимодействии с органикой! (она почти всегда где-то есть)
Получение хлора в лаборатории:
KMnO4(т)+ HClк→ MnCl2+Cl2+KCl+H2O(г); +H2SO4(к) – в установке должна быть включена тяга, а иначе H2SO4(к) пойдёт обратно к KMnO4(т) и произойдёт взрыв
KMnO4→t K2MnO4 + MnO2 + O2
Дробная реакция
Mn2++NaBiO3+H+(азотная) →2 MnO4-+5Bi3++5Na++7 H2O – малиновое окрашивание
(Вместо NaBiO3 можно использовать Pb3O4 или PbO2, но тогда придется нагревать, в результате чего MnO4- будет менее устойчивым)
60. Химическое равновесие. Константа химического равновесия.
Все системы по своей устойчивости делятся на: 1)стабильные, 2)нестабильные. Система всегда стремится к стабильному состоянию (равновесному).
Химическое равновесие (х/р) – такое состояние системы, при котором скорость прямой реакции равна скорости обратной реакции, при неизменных внешних условиях.
Химическое равновесие имеет динамический характер. Это значит, что и прямая и обратная реакции при равновесии не прекращаются.
При равенстве скоростей прямой и обратной реакции Vпр =V обр справедливо равенство
k пр[A] [B] = k обр [С] [D], => kпр./kобр.=[C][D]/[A][B] - Kp -константа химического равновесия
В случае при: aA + bB ↔ cC + dD Kc=[C]c[D]d/[A]a[B]b
Формулировка закона действующих масс:
При постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам в уравнении реакции.
В выражение константы равновесия гетерогенной реакции входят только концентрации веществ, находящихся в жидкой или газообразной фазе, так как концентрации твердых веществ остаются, как правило, постоянными.
Например, выражение для константы равновесия следующей реакции СО2 (г) + С(тв)↔ 2СО(г) записывается так: Кр = [CO]2/[CO2].
Уравнение константы равновесия показывает, что в условиях равновесия концентрации всех веществ, участвующих в реакции, связаны между собой. Численное значение константы равновесия определяет соотношение концентраций всех реагирующих веществ при равновесии.
Величина константы равновесия зависит от природы реагирующих веществ и температуры. Константа равновесия не зависит от концентраций (как и константа скорости реакции), механизма реакции, энергии активации, от присутствия катализаторов.
Константа равновесия определяется экспериментально. Численное значение Кр характеризует положение равновесия при данной температуре и не меняется с изменением концентраций реагирующих веществ. H2+I2↔2HI
V1=k1[H2][I2], V2=k2[HI]2, k1[H2][I2]=k2[HI]2, k1/k2=[HI]2 /[H2][I2]=Kр
Cисх.=0 для продукта реакции, Cисх.=[ ]+Cвступившее в реакцию вещество
 2018-01-21
2018-01-21 3506
3506
