Или
Или
Рис. 1.2. Комплексный ион [NiCl4]2–
Суммарную реакцию образования комплексного иона можно записать:
 Ni2+ + 4 Сl– [NiCl4]2–.
Ni2+ + 4 Сl– [NiCl4]2–.
Химические связи, возникающие при комплексообразовании за счет неподеленной электронной пары одного из взаимодействующих атомов (ионов) и свободной орбитали другого атома (иона), называются донорно-акцепторными координационными связями. Нейтральные молекулы или ионы, отдающие свои неподеленные пары электронов в «общее пользование», называются донорными; атомы (ионы)-комплексообразователи, предоставляющие свободные орбитали для размещения этих электронов – акцепторными.
|
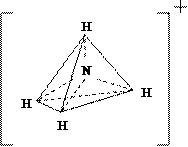 Идентичные химические связи, с тетраэдрической направленностью sp3-гибридных орбиталей, возникают в ионе NH4+, при взаимодействии молекул аммиака с протоном H+; ионе BF4–, при взаимодействии BF3 с анионом F– (рис. 1.3):
Идентичные химические связи, с тетраэдрической направленностью sp3-гибридных орбиталей, возникают в ионе NH4+, при взаимодействии молекул аммиака с протоном H+; ионе BF4–, при взаимодействии BF3 с анионом F– (рис. 1.3): или 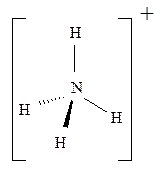
Рис. 1.3. Тетраэдрическая конфигурация атома азота в ионе NH4+
Изложенное позволяет дать общее определение комплексным соединениям. Комплексными называются соединения, в узлах кристаллической решетки которых находятся сложные частицы (комплексные ионы), построенные за счет координации одним атомом (ионом) электронейтральных молекул или противоположно заряженных других ионов, способные к самостоятельному существованию при переходе соединения в расплавленное или растворенное состояние.
Лиганды отличаются по силе своего воздействия на комплексообразователи. Объясняется это энергетическим потенциалом лигандов. По величине энергии лиганды располагаются в следующем порядке (спектрохимический ряд лигандов):
СО > СN– > NH2-CH2-CH2-NH2 > NH3 > SCN– > H2O > OH– > F– >Cl– > Br– > I–
сильное: среднее поле: слабое поле
поле
В начале этого ряда находятся лиганды, создающие наиболее сильное поле, в конце – слабое.
 Лиганды, создающие сильное поле, оказывают более значительное влияние на энергетическое состояние d-подуровня комплексообразователя. В результате меняется распределение электронов по орбиталям, что будет вести к иному типу гибридизации, а в итоге к иной структуре и к иным свойствам образующегося комплексного соединения. Так, если в комплексной соли K2[NiCl4] четыре вакантные орбитали иона Ni2+ под влиянием слабого поля Cl– находятся в состоянии sp3-гибридизации, с тетраэдрическим расположением лигандов в пространстве (рис. 1.2), то в комплексной соли никеля (II) c цианид-ионами (K2[Ni(CN)4]) тетраэдрическая конфигурация комплексного иона трансформируется в плоскостную квадратную (рис. 1.4.). Вызвано это тем, что во втором комплексе, под влиянием сильного электрического поля цианид-ионов, сначала имеет место обобщение двух
Лиганды, создающие сильное поле, оказывают более значительное влияние на энергетическое состояние d-подуровня комплексообразователя. В результате меняется распределение электронов по орбиталям, что будет вести к иному типу гибридизации, а в итоге к иной структуре и к иным свойствам образующегося комплексного соединения. Так, если в комплексной соли K2[NiCl4] четыре вакантные орбитали иона Ni2+ под влиянием слабого поля Cl– находятся в состоянии sp3-гибридизации, с тетраэдрическим расположением лигандов в пространстве (рис. 1.2), то в комплексной соли никеля (II) c цианид-ионами (K2[Ni(CN)4]) тетраэдрическая конфигурация комплексного иона трансформируется в плоскостную квадратную (рис. 1.4.). Вызвано это тем, что во втором комплексе, под влиянием сильного электрического поля цианид-ионов, сначала имеет место обобщение двух
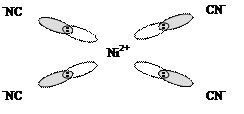
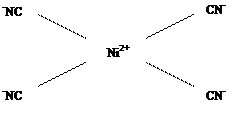
Рис. 1.4. Комплексный ион [Ni(CN)4]2–
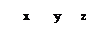 неспаренных d-электронов Ni2+, которые занимают 3dz2-орбиталь (см. ниже схему), а освободившаяся 3d x2–y2 - орбиталь, а также 4s- и две 4р-орбитали участвуют далее в гибридизации с образованием четырех эквивалентных dsp2-орбиталей, направленных в плоскость квадрата:
неспаренных d-электронов Ni2+, которые занимают 3dz2-орбиталь (см. ниже схему), а освободившаяся 3d x2–y2 - орбиталь, а также 4s- и две 4р-орбитали участвуют далее в гибридизации с образованием четырех эквивалентных dsp2-орбиталей, направленных в плоскость квадрата:

 |

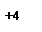
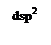


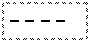
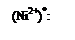

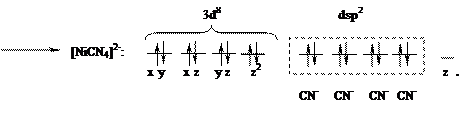
В комплексе с цианид-ионами у центрального иона не остается неспаренных электронов и он не обладает магнитными свойствами (диамагнитен, μ = 0). При комплексообразовании с ионами хлора, имеющими слабое поле, два электрона не спарены. Неспаренные электроны, вращаясь вокруг собственных осей, создают магнитный момент. Магнитный момент молекул (μ) складывается из магнитных моментов неспаренных электронов. Если молекула содержит неспаренные электроны, то μ≠0 и вещество парамагнитно, т.е. втягивается в магнитное поле. Когда неспаренных электронов нет и μ = 0, вещество диамагнитно и слабо выталкивается из магнитного поля. Наличие двух неспаренных электронов у атома Ni2+ в комплексе K2[NiCl4] обуславливает его парамагнетизм.
Достоинство метода валентных связей в том, что уже многие десятилетия он дает химикам простую, наглядную модель связывания атомов, успешно объясняет определенные значения координационных чисел и геометрические формы комплексных частиц. Правильно описываются с позиций метода и различия в магнитных свойствах – диамагнитизм и парамагнетизм. Однако основанный на ряде допущений, он не в состоянии объяснить спектры поглощения и строение некоторых, особенно открытых в последнее время, комплексов, например, «сэндвичевых». Кроме того, взаимодействие центрального атома (иона) с лигандами не всегда сводится к элементарному акту передачи электронов лигандом. Известны лиганды, сами способные принимать электроны металла на свои вакантные орбитали, например, на свободные d-орбитали в молекуле PF3 или в ионе SnCl3–. Сомнительно также, чтобы на центральном ионе могла осуществляться концентрация столь высокого отрицательного заряда, который бы создавался, если бы каждый лиганд стал отдавать ему свою пару электронов.
Среди различных подходов к объяснению образования комплексного иона наиболее общий дает метод молекулярных орбиталей. Впервые к комплексным соединениям он был применен Ван-Флеком в 1935 г. При описании координационной связи в комплексном ионе в методе молекулярных орбиталей учитываются не только вакантные атомные орбитали иона-комплексообразователя, что характерно для метода валентных связей, но и орбитали, координирующихся вокруг комплексообразователя n лигандов. Формирование молекулярных орбиталей в комплексных соединениях осуществляется по тому же принципу, что и в простых бинарных молекулах. Отличие заключается в том, что в комплексном ионе молекулярные орбитали многоцентровые и делокализованные, как, например, в молекуле бензола или содержащих циклические ядра «сэндвичевых» комплексах – дибензолхроме [Cr(C6H6)2] и ферроцене [Fe(C5H5)2]. В последних примерах атомы металлов находятся между циклическими органическими структурами, энергия которых равномерно распределена (делокализована) по обоим циклам, в результате чего центральный атом в равной степени взаимосвязан со всеми атомами комплекса.
 Комплексные соединения известны практически для всех элементов таблицы Менделеева. f-элементам свойственна наивысшая комплексообразующая способность, но актиноиды и лантаноиды короткоживущие элементы. Поэтому среди стабильных элементов d-элементы, имеющие свободные орбитали на внешнем уровне и незавершенные предвнешние уровни, обладают наиболее высокой способностью к комплексообразованию, а их комплексы наиболее прочны. Среди комплексов d-элементов для жизнедеятельности человека наиболее важны природные соединения Mn, Fe, Co, Cu, Zn, Mo. Амфотерные р-элементы: Al, Sn, Pb и др., имеющие три р-орбитали, более слабые комплексообразователи. Комплексообразующая способность s-элементов самая малая, – более чем на порядок ниже, чем у p-элементов. Биогенные s-элементы Na, K, Ca, Mg могут образовывать непрочные комплексы только с лигандами определенной структуры. Таким образом, в блоках периодической системы способность к комплексообразованию уменьшается в следующем порядке: f > d > p >> s.
Комплексные соединения известны практически для всех элементов таблицы Менделеева. f-элементам свойственна наивысшая комплексообразующая способность, но актиноиды и лантаноиды короткоживущие элементы. Поэтому среди стабильных элементов d-элементы, имеющие свободные орбитали на внешнем уровне и незавершенные предвнешние уровни, обладают наиболее высокой способностью к комплексообразованию, а их комплексы наиболее прочны. Среди комплексов d-элементов для жизнедеятельности человека наиболее важны природные соединения Mn, Fe, Co, Cu, Zn, Mo. Амфотерные р-элементы: Al, Sn, Pb и др., имеющие три р-орбитали, более слабые комплексообразователи. Комплексообразующая способность s-элементов самая малая, – более чем на порядок ниже, чем у p-элементов. Биогенные s-элементы Na, K, Ca, Mg могут образовывать непрочные комплексы только с лигандами определенной структуры. Таким образом, в блоках периодической системы способность к комплексообразованию уменьшается в следующем порядке: f > d > p >> s.
Различия в комплексообразующей способности прослеживаются не только между элементами отдельных s, p, d, f-семейств периодической системы, но и между элементами одного семейства. Среди многообразия факторов, влияющих на комплексообразование, можно выделить несколько основных, прямо связанных с природой и строением иона комплексообразователя.
Для иона комплексообразователя, имеющего электронную конфигурацию инертного газа (s2 или ns2np6 – щелочные и щелочно-земельные металлы; многие элементы побочных подгрупп 3-8 групп, в высшей степени окисления), псевдоинертного ((n-1)d10 – Cu+, Ag+, Au+, Zn2+, Cd2+, Ga3+, In3+, Sn4+, Pb4+, Sb5+, Bi5+) или псевдоинертного газа плюс два электрона ((n-1)d10ns2 – Ga+, In+, Sn2+, Pb2+, Sb3+, Bi3+) комплексообразующая способность зависит главным образом от эффективного ионного радиуса и эффективного заряда ядра атома. Если отношение заряда катиона к его радиусу в кристалле принять за φ – ионный потенциал, то можно показать, что способность к образованию комплексных соединений ионами металлов с небольшими или многозарядными ионными и полидентатными лигандами увеличивается по мере возрастания ионного потенциала. Наблюдаемая последовательность для ионов с одним и тем же зарядом подтверждает такое предположение: Li+ > Na+ > K+ > Rb+ > Cs+; Mg2+ > Ca2+ > Sr2+ > Ba2+ > Ra2+; Al3+ > Sc3+ > Y3+ > La3+. Аналогичная закономерность свойственна ионам с различными зарядами, но примерно одинакового размера: Y3+ > Ca2+ > Na+; La3+ > Sr2+ > K+.
Несоответствие возникает при сравнении близких по размеру и заряду представителей одной и той же группы периодической системы, например: K и Cu+, Ca и Cd, Sc и Ga3+. Элементы побочной подгруппы всегда более сильные комплексообразователи, по сравнению с элементами главной, и причина этого кроется в различии электронных конфигураций. Ионы элементов главной подгруппы имеют конфигурацию инертного газа ns2np6, а ионы побочной – псевдоинертного (n-1)d10, либо псевдоинертного плюс два электрона (n-1)d10ns2. Последние конфигурации в меньшей степени экранируют заряд ядра положительного одноатомного иона, из-за чего эффективный заряд ядра для ионов элементов побочной подгруппы в действительности выше, чем для ионов элементов главной. Например, для иона Cu+ он больше, чем для иона K+.
Значение эффективного заряда можно найти по величинам энергий ионизации. Так, хотя Na+ и Cu+ почти одинаковы по размеру (0,95 и 0,93 Ǻ), энергия ионизации для Na+ равна 118,5 ккал/моль, а для Cu+ - 178 ккал/моль. Это различие связано с наличием у иона Cu+ большего сродства к электрону, что приводит к большему притяжению электронов лиганда к меди, чем к иону натрия.
Для ионов металлов с конфигурацией инертного газа, как s, p так и d-элементов, комплексообразование не является характерным. Несравненно более высокую комплексообразующую способность проявляют ионы переходных металлов, когда d-орбитали незаполнены – (n-1)d1-9. Это означает, что для формирования донорно-акцепторных связей, образования устойчивых комплексных соединений принципиальное значение имеет не только величина φ потенциала катиона, но и наличие, а также число свободных орбиталей на d-подуровне, которые могут быть «заселены» неподеленными парами электронов лиганда.
Значительное влияние на процесс комплексообразования оказывает расщепляемость незаполненного d-подуровня под воздействием силового поля лиганда. Лиганды, окружая центральный ион, способны возбуждать его, изменяя взаимную ориентацию d-орбиталей. При этом, испытывая влияние лигандов, наиболее сильному возбуждению подвергаются ближайшие к иону dx2-y2 и dz2 орбитали, меньшему – удаленные – dxy, dxz и dyz. В результате ранее единый энергетический подуровень из пяти d-орбиталей центрального иона расщепляется на два разных энергетических подуровня:
 |
Рассмотрим это на примере иона железа Fe2+. Его электронная конфигурация описывается формулой 3d6. В свободном ионе распределение электронов подчиняется правилу Хунда:
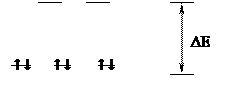
Возникает синглентное состояние центрального атома (отсутствие неспаренных электронов). Выравнивание энергии двух свободных 3d-орбиталей и энергий одной 4s- и трех 4p-орбиталей способствует более легкому их смешиванию (d2sp3-гибридизация) с формированием устойчивого октаэдрического комплекса. Рассмотренный феномен имеет существенное значение, так как обусловливает важнейшую биологическую функцию – транспорт кислорода гемоглобином, в состав которого входит двухвалентное железо.
Для s- и p-элементов эффект расщепления невозможен, что снижает комплексообразующую способность ионов этих металлов.
 2014-02-09
2014-02-09 2228
2228
