Название основного закона химической кинетики связано с работами норвежских ученых Гульдберга и Вааге, опубликованными в 1864 и 1867 гг. Этими исследователями было экспериментально показано, что скорость реакции пропорциональна произведению "масс реагентов в реакции", то есть "действующих масс", откуда и возникло название.
В реальных химических реакциях одновременное столкновение между собой уже трех реагирующих частиц - редкое событие, поэтому таких реакций немного. Большинство химических реакций происходит либо при распаде одной частицы (А = Б + В + Г…), либо при столкновении между собой двух частиц (А + Б = В + Г…). Если уравнение реакции сложное, то, скорее всего, она включает в себя несколько более простых реакций, каждая из которых происходит путем попарных столкновений, либо путем распада одной частицы. Эти простые реакции называютэлементарными реакциями. Только для таких - элементарных реакций - справедливо кинетическое уравнение (3).
Приведем пример. Для окислительно-восстановительной реакции:
K2Cr2O7 + 14 HI = 3 I2 + 2 CrI3 + 2 KI + 7 H2O
не следует торопиться записать кинетическое уравнение:
v = k[K2Cr2O7][HI]14 (неправильно!)
Эта сложная реакция на самом деле включает в себя несколько простых (элементарных) реакций. Трудно представить, что для образования продуктов должны одновременно столкнуться между собой одна молекула K2Cr2O7 и 14 молекул HI. Это совершенно невероятное событие! Кроме того, оба исходных соединения распадаются в растворе на ионы, поэтому трудно даже ожидать, что между собой должны столкнуться частицы восстановителя (I-) и окислителя (Cr2O72-) в виде анионов (ведь они отталкиваются друг от друга). Ион Cr2O72- должен претерпеть ряд сложных превращений, прежде чем превратится в частицу, столкновение которой с ионом иода действительно приведет к химической реакции. Для этого должно произойти несколько элементарных реакций, каждая из которых описывается своим собственным (простым) кинетическим уравнением и имеет свою константу скорости.
В итоге общую скорость реакции определяет какая-то самая медленная элементарная реакция. Такая реакция называется лимитирующей стадией. Как же найти общее кинетическое уравнение для нашей окислительно-восстановительной реакции? Сделать это можно только экспериментально. Оказалось, что скорость данной реакции при 25 оС зависит только от концентрации бихромата калия и НЕ ЗАВИСИТ от концентрации иодоводородной кислоты HI:
v = k[K2Cr2O7]
Приведем другой пример. Изучение реакции окисления NO кислородом показало, что в этом случае кинетическое уравнение соответствует полному химическому уравнению:
2 NO + O2 = 2 NO2
v = k[NO]2[O2]
Это редкий пример тримолекулярной реакции. Молекулярность реакции - это число исходных частиц, одновременно взаимодействующих друг с другом в одном элементарном акте реакции. Молекулярность реакции может составлять 1, 2 или 3. Соответственно различаютмономолекулярные, бимолекулярные и тримолекулярные реакции. Например, реакция NH4+ = NH3 + H+ является мономолекулярной, а реакция H+ + OH- = H2O - бимолекулярной.
О кинетическом уравнении v = k[A]a[B]b[C]c говорят, что оно имеет порядок по каждому из входящих в него веществ. Порядок реакции по данному веществу - это показатель степени при концентрации данного вещества в кинетическом уравнении. Например, уравнение v = k[NO]2[O2] имеет второй порядок по NO и первый порядок по О2. Сумма порядков по всем веществам (a + b + c) называется общим или суммарным порядком реакции. Например, кинетическое уравнение v = k[H+][OH-] имеет общий второй порядок. Уравнение v = k[NO]2[O2] имеет общий третий порядок. Уравнения типа v = k[NH4+] или v = k[K2Cr2O7] - первого порядка.
Для элементарных реакций порядок реакции - целочисленная величина, совпадающая с молекулярностью реакции. Для всех других (не элементарных, сложных) реакций их порядки можно определить только экспериментально. Причем они могут иметь как целочисленные, так и дробные и (даже нулевое!) значение. В реальных кинетических исследованиях редко встречается порядок реакции выше третьего.
Кинетические уравнения, рассмотренные в предыдущем параграфе, справедливы только для гомогенных реакций, т.е. для таких реакций, которые идут в какой-нибудь одной фазе – газовой или жидкой. Например, это могут быть реакции между двумя газами, либо реакции, протекающие при сливании растворов:
NO2(г) + CO(г) = NO(г) + CO2(г);
NaOH(р-р) + HCl(р-р) = NaCl(р-р) + H2O.
Но существует и множество других реакций, происходящих на границах раздела фаз – между газообразным веществом и раствором, между раствором и твердым веществом, между твердым и газообразным веществами. Такие реакции называются гетерогенными. В качестве типичного примера гетерогенной реакции рассмотрим лабораторный метод получения водорода из металлического цинка и разбавленной серной кислоты:
Zn(тв) + H2SO4(р-р) = H2(г) + ZnSO4(р-р)
79. Хлорная кислота и перхлораты. Их получение, химические свойства и устойчивость.
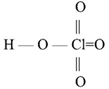
HClO4 – хлорная кислота – сильный окислитель.
Бесцветная летучая жидкость, сильно дымящая на воздухе. Взрывоопасна.
Безводная хлорная кислота очень реакционноспособна и неустойчива.
Для жидкой HClO4 характерна равновесная автодегидратация:
3HClO4 = H3O+ + ClO4- + Cl2O72-
Получение:
KClO4 + H2SO4 = KHSO4 + HClO4
Химические свойства:
· Растворяет золото и платиновые металлы, а в реакции с серебром образует хлорноватую кислоту:
3HClO4 + 2Ag = HClO3 + 2AgClO4 + H2O
· Неметаллы и активные металлы восстанавливают хлорную кислоту до хлороводорода:
8As + 5HClO4 + 12H2O = 8H3AsO4 + 5HCl
· Разложение (в силу неустойчивости):
3HClO4 = 4ClO2 + 3O2 + 2H2O
Перхлораты (ClO4-) - соли хлорной кислоты.
Получение:
В промышленности синтезируются:
KClO3 = KCl + KClO4 (400 °C)
NH3 + HClO4 = NH4ClO4
Остальные неорганические перхлораты могут быть либо получены действием хлорной кислоты на соли, оксиды или гидроксиды металлов, а также обменными реакциями.
Химические свойства:
Разложение может идти по двум направлениям:
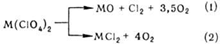
У перхлоратов Be, В, Al, Fe, Ti, Zr, Hf, Со, Cr преобладает направление (1), у перхлоратов Cd, Hg(II) преобладает направление (2), у перхлоратов Mg, Zn, Hg(I), Cu распад идет по обоим направлениям одновременно.
80. Соли аммония. Их поведение в водных растворах и при нагревании. Действие солей аммония на щелочные растворы, содержащие Zn и Al.
NH4+ - аммоний. Соли аммония – сильные электролиты.
В водном растворе подвергаются гидролизу:
NH4Cl + H2O = NH4OH + HCl
При ↑t разлагаются, так как обладают невысокой термической устойчивостью:
если анион образован:
Ø кислотой-окислителем:
NH4NO3 → N2O↑ + 2H2O
NH4NO2 → N2↑ + 2H2O
Ø кислотой, не явл. окислителем:
(NH4)3PO4 → 3NH3↑ + H3PO4
NH4H2PO4 → NH3↑ + H3PO4
Ø летучей кислотой (галогеноводородом)
NH4Г → NH3↑ + HГ↑
В растворах с pH<7 реагируют с кислотами и солями; в растворах с pH>7 – с щелочами с образованием NH3 (качественная реакция на ион NH4+):
NH4Cl + NaOH → NaCl + NH3↑ + H2O
Действие на щелочные растворы, содержащие Zn(II) Al(III):
Na2[Zn(OH)4] + 2NH4Cl → 2NaCl + Zn(OH)2 + 2NH3↑ + 2H2O
Na3[Al(OH)6] + 3NH4Cl → 3NaCl + Al(OH)3 + 3NH3↑ + 3H2O
81. Ионные реакции с участием комплексных соединений.
Комплексные ионы являются слабыми электролитами, поэтому ионные реакции с участием комплексных соединений весьма распространены.
В химической практике широко применяется растворение малорастворимых соединений - солей и гидроксидов - действием растворов, содержащих лиганды:
ZnCO3 + 4NH4OH = [Zn(NH3)4]CO3 + 4H2O
Cu(OH)2 + 4NH4OH = [Cu(NH3)4](OH)2+ 4H2O
HgO + 4KI + H2O = K2[HgI4] + 2KOH
Амфотерные гидроксиды при действии растворов щелочей образуют гидроксокомплексы:
Zn(OH)2 + 2NaOH → Na2[Zn(OH)4]
Гидроксиды алюминия и хрома(III) при действии разбавленных растворов щелочей переходят в тетрагидроксокомплексы, а при действии концентрированных - в гексагидроксокомплексы:
Al(OH)3 + NaOH → Na[Al(OH)4]
Al(OH)3 + 3NaOH → Na3[Al(OH)6]
Если к солям типа Pb(NO3)2 AlCl3 медленно добавлять раствор щелочи, то сначала наблюдается образование осадков гидроксидов, которые в дальнейшем при добавлении той же щелочи растворяются.
Pb(NO3)2 + 2NaOH → Pb(OH)2 + 2NaNO3
Pb(OH)2 + 2NaOH → Na2[Pb(OH)4]
Малорастворимые соли металлов, имеющих амфотерные оксиды, часто растворяются в растворах щелочей:
AlPO4 + 4NaOH → Na[Al(OH)4] + Na3PO4
Комплексные соединения могут разрушаться, если добавляемый реагент имеет малорастворимую соль или вызывает образование слабого электролита, в т.ч. и нового комплексного соединения:
[Zn(NH3)4]Cl2 + Na2S = ZnS + 4NH3 + 2NaCl
K3[Fe(NCS)6] + 6KF = K3[FeF6] + 6KNCS
 2018-01-21
2018-01-21 837
837







