Большинство биологических объектов доступно для исследования лишь в виде дискретных единиц, которые можно соразмерить с частицами различных порошков. Известно, что спектроскопия НПВО при θ > θ кр может быть использована для получения спектров порошков с любым размером частиц. Причем преимущество методов НПВО применительно к порошкам заключается не только в отсутствии рассеяния, с помощью этого метода можно получать спектры порошков с большим размером частиц и поэтому непригодных для исследования методами обычной спектроскопии.
Известно, что контрастность спектров НПВО порошков зависит от размера частиц. Эта зависимость обусловлена характером упаковки частиц. Естественно предположить, что контрастность спектров микроорганизмов будет зависеть от плотности упаковки и их формы. Так, например, даже в случае плотной упаковки шарообразных клеток объем межклеточного пространства занимает около 16%. Естественно также предположить, что при нанесении микроорганизмов на ИЭ из суспензии и подсушивании в токе воздуха при комнатной температуре или при нанесении их на ИЭ в аэрозольной камере, плотность упаковки будет иной, нежели это следует из теоретических расчетов общего объема клеток на поверхности элемента. Т.е. объемная концентрация микроорганизмов на поверхности ИЭ разных микроорганизмов может оказаться различной. Проанализируем интенсивность полос поглощения для клеток различной формы и размеров.
|
|
|
Незаполненное пространство клеточной массой можно определить следующим образом. В основу этого определения положен принцип "подходящего индикатора". Если к нанесенным на поверхность ИЭ микроорганизмам добавить известное количество другого вещества, растворенного в воде, то разность показаний спектрофотометра между оптической плотностью поглощения в аналитической полосе индикатора при отсутствии микроорганизмов и в их присутствии пропорциональна концентрации (объему) сухого вещества клеток или же объему незаполненного пространства.
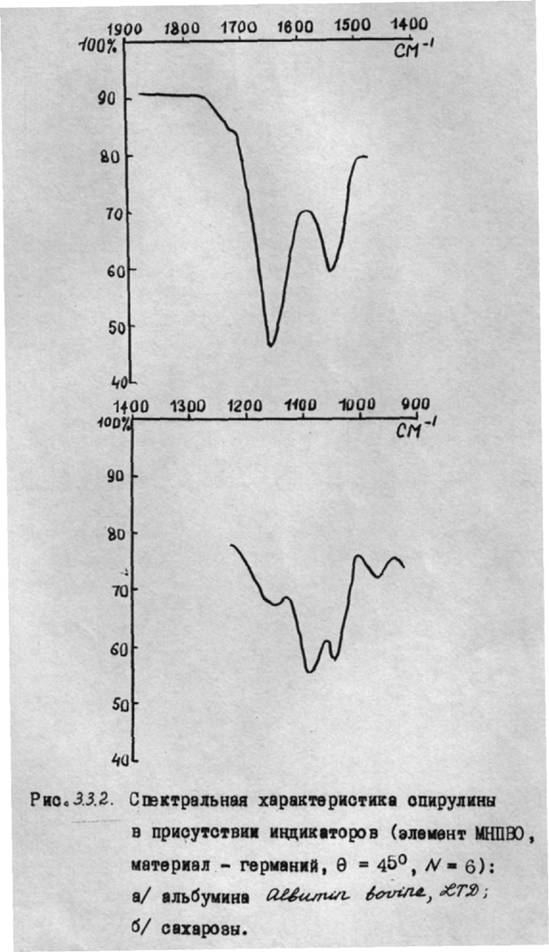
В качестве индикатора при работе с клетками хорошо использовать сахарозу, имеющую поглощение в области 1100 смˉ¹.
При записи спектров использовали два режима работы: режим "массивного образца" (МО) и "тонкой пленки" (ТП). Рассмотрим их в отдельности.
Режим МО. Если свет проникает в среду, обладающую поглощением, то R = f(dэф). В этом случае R будет зависеть не только от показателя поглощения К, но также от θ, относительного показателя поглощения n21 = n2 / n1 и числа отражений N, входящих в выражение для dэф. Т.е. зная перечисленные параметры, не представляет труда рассчитать глубину проникновения луча в среду, состоящую из микроорганизмов и индикатора - сахарозы. Это означает, что при совпадении показателей преломления индикатора и микроорганизмов в анализируемой полосе поглощения стабилизация объема измеряемого вещества происходит автоматически. Коэффициент отражения R, который определяется из эксперимента, прямо пропорционален глубине проникновения. Поэтому после проверки выполнимости закона Бугера-Ламберта-Бера для индикатора в диапазоне оптических плотностей, используемых при определении объема незаполненного клетками пространства, определяем этот объем.
|
|
|
На рис.3.1 представлены спектральные характеристики массивных образцов индикаторов, которые были использованы при определении межклеточного пространства на ИЭ.
На рис.3.2а и 3.2б - спектры некоторых микроорганизмов в присутствии индикаторов (для массивных образцов).
Как следует из полученных спектральных характеристик МНПВО, аналитические полосы индикаторов накладываются на полосы поглощения микроорганизмов. Однако задача количественного определения объема межклеточного пространства разрешима, если оптическая плотность избранной аналитической полосы представляет собой сумму оптических плотностей отдельных компонентов - индикатора и микроорганизмов. Это условие является необходимым и поэтому его выполнение всегда должно быть проверено экспериментально.
Для выбранных аналитических полос можно записать
D = D1 + D2 = α1d1эф N + α2d2эфN,
где D1 и D2 - оптическая плотность индикатора и микроорганизмов соответственно;
α1 и α2 - показатели поглощения индикаторов и микроорганизмов сосоответственно (α = εС, где ε - экстинкция, л/см *моль; С - концентрация, моль/л);
d1эф и d2эф - соответственно эффективные толщины индикатора и микроорганизмов, см;
N - число отражений.
Оптические плотности индикатора и микроорганизмов (в случае массивных образцов), равные D = -lgRN = αdэфN, определяются из эксперимента для разных ИЭ-тов и микроорганизмов.
Зная D, D2, а также воспользовавшись зависимостью D1 = f(Vоб), находим объем межклеточного пространства для ряда микроорганизмов с различными размерами и формой, нанесенных на ИЭ. Полученные результаты представлены в таблице 3.1. В таблице представлены наибольшие полученные значения объема межклеточного пространства.

|
|
Таблица 3.1.
__________________________________________________________
измерительный объем межклеточного пространства,%
элемент ___________________________________________
при θ=45О E.coli Cand.quil. Act.aureof. Chl.vulgar. Spirul.plat.
__________________________________________________________
германий 10 12 20 15 23
кремний 10 10 17 11 20
__________________________________________________________
Анализируя результаты, представленные в таблице, можно заметить, что для измерительных элементов, выполненных из разных материалов, значения объема незаполненного пространства для одних и тех же микроорганизмов несколько отличаются. Это можно объяснить особенностями адсорбции микроорганизмов на поверхности ИЭ-тов.
Может возникнуть вопрос: почему бы не провести измерение объема межклеточного пространства по количественным измерениям объема, занимаемого микроорганизмами, с использованием аналитической полосы поглощения микроорганизмами?
Проведенный анализ оптических плотностей массивных образцов различных микроорганизмов показывает, что имеется некоторое несоответствие между полученными результатами по определению межклеточного пространства с помощью индикатора и по полосам поглощения микроорганизмов. Это можно объяснить тем, что микроорганизмы имеют отличия в процентных отношениях к сухому весу основных биохимических компонентов, ответственных за полосы поглощения, что известно из литературы. Проведенный биохимический анализ на клеточный белок и углеводы подтверждает сделанные выводы. Если же измерения проводятся с заранее известными микроорганизмами (известно процентное содержание основных компонентов по отношению к
|
|
|
сухому весу), то, учитывая их форму и размеры, можно повысить точность количественного анализа.
Обнаруженное различие будет отчасти определяться и следующим. Поскольку разные микроорганизмы имеют отличие по толщине, а ИЭ-ты с разными характеристиками обеспечивают различную глубину проникновения света в анализируемые клетки, то для разных микроорганизмов свет взаимодействует с неодинаковыми цитоструктурными комплексами, содержащими, естественно, неодинаковое количество основных компонентов, образующих эти структуры.
Итак, на основании анализа результатов измерений, проведенных в режиме массивного образца, можно сделать вывод, что объем межклеточного пространства для микроорганизмов с различной формой и размерами, нанесенных на ИЭ-ты, отличается максимально на 13% и что, исходя из средней величины этого разброса (6,5%), можно проводить измерения сред, в которых находятся микроорганизмы, с достаточной для практических целей точностью без учета их формы и размеров.
Режим ТП. При записи спектров в режиме "тонкой пленки" глубина проникновения светового потока dр превышает толщину объекта исследования (в конкретном случае толщину микроорганизмов), поэтому представляется возможность определять общее количество основных компонентов клетки независимо от ее формы и размеров. В этом режиме записи спектров наиболее удобно вести количественные измерения, так как интенсивность аналитических полос поглощения будет пропорциональна общему количеству определенного вещества, ответственного за поглощение в выбранной аналитической полосе.
Однако реализация данного режима при записи спектральных характеристик микроорганизмов встречает ряд особенностей, на которых мы остановимся более подробно в следующих разделах.
.
4. Модели клеток для теоретического анализа
|
|
|
В разделе рассмотрены некоторые модели клеток, которые позволяют анализировать изменения в спектрах НПВО в зависимости от формы и размеров образцов, от заполнения рабочих поверхностей ИЭ, от углов θ, от поляризации, что дает выбор условий для оптимального эксперимента.
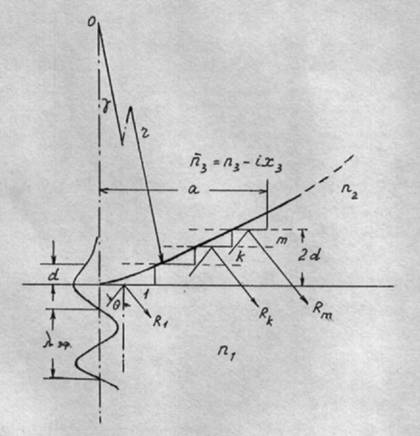
Известно, что рассеянием света в режиме НПВО можно пренебречь. Это позволяет с хорошим приближением считать, что взаимодействие света и вещества связано преимущественно с ослаблением света за счет резонансного поглощения на тех частотах, для которых мнимая часть комплексного показателя преломления объекта n = n1 – ix не равна нулю. В этом случае взаимодействие затухающей световой волны с объектом, когда Ǿ > λэф, а θ > θ кр может быть описано с помощью модельного подхода. При этом поверхность клетки условно заменяется плоскопараллельным набором ступенек (слоев), которые располагаются по контуру реальной поверхности частицы и постепенно удаляются от границы раздела "ИЭ - воздух" (рис. 4.1). Разбиение на слои производится в пространстве, ограниченном рабочей поверхностью ИЭ и поверхностью образца, удаленной от границы раздела на расстояние, равное глубине проникновения излучения в образец, где интенсивность поля световой волны ослабевает в e раз. Независимо от шага разбиения, каждая ступенька рассматривается в качестве самостоятельной плоскости, отражающей свет. Поэтому считаем, что пучок света падает на каждую ступеньку под одинаковым углом. Таким образом, отражение от той или иной ступеньки будет зависеть только от ее оптических свойств и зазора (воздух, другая среда), отделяющего поверхность ИЭ от рассматриваемой ступеньки. Вклад отдельно взятой ступеньки в суммарный коэффициент отражения R определяется формой образца. Когда образцы имеют форму цилиндров (или кубических кристаллов), величина R есть среднеарифметическое от суммы коэффициентов отражения, найденных для отдельных слоев:
m
R = (1/m) Σ Rк, (4.1)
k=1
где m - число ступенек,
к - порядковый номер ступеньки,
Rк - коэффициент отражения к-ой ступеньки (определяется по формулам Френеля).
При расчете R предполагается, что оптические свойства всех слоев идентичны свойствам массивного образца. Шаг деления выбирается с учетом неравенства а >> λэф, "а" определяется из выражения: а = 2d·ctg(γ/2), где γ = arccos(r-2d)rˉ¹.
|
Рис. 4.1.
Для сферической изотропной частицы при равномерном шаге разбиения на ступени величину R находится из выражения:
m
R = (1/m²) Σ Rк (2k-1). (4.2)
k=1
В отличие от (4.1) коэффициент Rк входит в выражение (4.2) каждый со своим весом, пропорциональным к-ой ступени. Площадь первой ступеньки принимается за единицу. Первая ступенька представляет собой круг, а все последующие являются кольцами с возрастающим радиусом.
В приведенных выражениях явным образом не учитываются размеры частицы. Известно, что для частиц диаметром 10-30 мкм вид экспериментальных спектров не зависит от их размеров. Когда они заметно крупнее или меньше 3 мкм, характер спектров меняется. В первом случае это объясняется, по-видимому, отличием формы от сферических, в другом - изменением эффективных оптических свойств среды, представляющей совокупную систему, состоящую из частиц и воздуха (или другой среды), заполняющего пространство между частицами. Крупные частицы обычно имеют плоскую огранку и соприкасаются с поверхностью ИЭ этими гранями, при этом вид спектров определяется вкладом членов Rк с малыми "к". Для малых частиц такой модельный подход неприменим и нужно переходить к дисперсионной теории взаимодействия света и вещества.
Из изложенного следует, что для анализа клеток большой интерес представляют модели, в которых каждый слой отличается от другого либо составом вещества, либо степенью пространственной организации, либо показателем преломления. В качестве модели распластанных клеток на поверхности ИЭ полагали структуру, состоящую из плоских параллельных слоев (рис. 4.2а), соответствующих щели 2 между плазматической мембраной и поверхностью 1 ИЭ, плазматической мембране 3, цитоплазме 4. 5-культуральная среда, hi и ni - ширина щели и показатель преломления слоя i. Эта модель применялась при исследовании адгезии фибробластов к стеклу. Эти модели используем далее для анализа получаемой информации при взаимодействии света и клеток, т.к. позволяют провести указанный выше теоретический анализ для всех предложенных в работе способов определения количества прореагировавшего со светом образца.
 2018-01-21
2018-01-21 953
953








