Различают различные способы выражения концентрации растворов:
1. Массовая доля растворенного вещества:
 ,
, 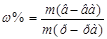 ∙100%
∙100%
m (в-ва), m(р-ра) в граммах.
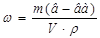 ,
,  ∙100%;
∙100%;
V – объем раствора в мл; ρ – плотность, г/см3, (г/мл).
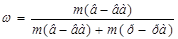 ,
,  ∙100%.
∙100%.
m(р-ра) в граммах.
2. Молярная концентрация:  , моль/л;
, моль/л;
где M(в-ва) – молярная масса вещества, рассчитывается по молекулярной формуле.
3. Молярная концентрация эквивалента N: CH= 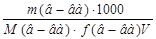 , моль/л;
, моль/л;
f(в-ва) – фактор эквивалентности вещества;
f(кислоты)=1/ число ионов Н+ в молекуле кислоты, участвующих в реакции;
f(основания)=1/ число ионов ОН- в молекуле основания, участвующих в реакции;
f(соли)=1/ число катионов в молекуле соли•заряд катиона;
f(окислителя)=1/ число ē, принятых 1 моль окислителя;
f(восстановит.)= 1/ число ē, отданных 1 моль восстановителя.
4. Моляльная концентрация: Смоляльная =  , моль/кг
, моль/кг
5. При взаимодействии растворов различных веществ друг с другом, имеющих молярную концентрацию эквивалента (нормальную концентрацию), используют формулу N1V1 = N2V2.
6. Если кислота одноосновна (HCl, HClO4), основание однокислотно (КОН, NaOH), то С(KOH) = N(KOH), C(HCl) = N(HCl).
7. Концентрацию любого иона в растворе электролита рассчитывают по формуле: [иона]=С(электролита) ∙ α(электролита) ∙ n(иона), где n(иона)-число ионов данного типа, образованное при диссоциации одной молекулы электролита.
Например, рассчитать концентрацию ионов OHˉ в растворе КОН. КОН 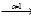 К+ + ОНˉ, n(ОНˉ)=1
К+ + ОНˉ, n(ОНˉ)=1
[OHˉ] = C(KOH) ∙ α(KOH) ∙ n(OHˉ).
α Сильных электролитов равна 1.
α Слабых электролитов: α=  , где
, где
Кд – константа диссоциации слабого электролита (по справочнику, Ка – Кд кислоты), С-молярная концентрация.
8. Кв = КW = [H+][OHˉ] = 10-14;
pH = - ℓg[H+]; [H+] = 10-pH;
pОH = - ℓg[OH-], [OHˉ] = 10-pOH;
pH + pOH = 14.
Задача 1. Моляльность раствора NaCl, содержащего 2 моль NaCl в 10 л воды, равна ……..0,2 моль/кг
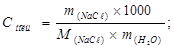
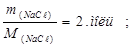
 = V
= V 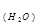 p
p 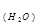 = 1 г/мл ∙ 10000 мл,
= 1 г/мл ∙ 10000 мл,  = 10000 г
= 10000 г
 .
.
Задача 2. Объём 0,5 М раствора НСl, необходимый для нейтрализации 50 мл 0,1 М раствора Ва(ОН)2, равен …………………………… 20 мл
Известно: 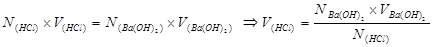 .
.

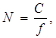 где f фактор эквивалентности.
где f фактор эквивалентности. ;
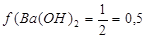 .
.
N(HCl) = C(HCl); , моль/л.
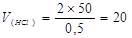 мл,
мл,
где С – молярная концентрация;
N – молярная концентрация эквивалента.
Задача 3. Масса Fe(OH)3 при взаимодействии 100 мл 0,1 М раствора FeCl3 c избытком NaOH, равна ………. 1,07 г
FeCl3 + 3NaOH →  Fe(OH)3 + 3NaCl
Fe(OH)3 + 3NaCl
1 моль 1 моль
0,1М 0,1 М 1 моль Fe(OH)3= 107 г/л
0,1 моль Fe(OH)3= 10,7 г/л.
При взаимодействии в 1000 мл раствора FeCl 3 будет образовываться 10,7 г Fe(OH)3, а при взаимодействии в 100 мл раствора FeCl 3 образуется 1,07 г Fe(OH)3.
Задача 4. Раствор H2SO4 имеет рН = 1. Концентрация H2SO4 в растворе при α = 100% равна ………………………………… 0,05 моль/л
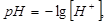
.
;
 ,
,  .
.
Задача 5. Сколько граммов воды нужно добавить к 500 г 60 %-ного раствора серной кислоты для получения 32 %-ного раствора кислоты? Сколько образуется 32 %-ного раствора серной кислоты.
Решаем задачу используя правило креста. Составим квадрат Пирсона и отношения для расчета массы воды (х г):
 60 % 60 % | 32-0 | 500 г | |
| 32 % | |||
| 0 % | 60-32 | х г |
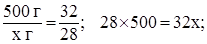
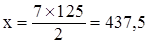
Масса воды равна 437,5 г.
Рассчитаем массу нового раствора по формуле:
m(р-ра)= m(Н2О)+m(в-ва);
m(р-ра)=500 г+437,5 г=937,5 г.
Ответ масса воды 437,5 г, масса раствора 937,5 г.
Эту задачу можно решить с использованием формулы для расчета массовой доли растворенного вещества:
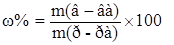 %.
%.
Найдем массу серной кислоты в 500 г 60 %-ного раствора:
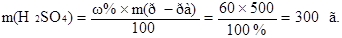
Найдем массу 32 %-ного раствора содержащего 300 г серной кислоты:

Рассчитаем массу воды, необходимую для получения 937,5 г раствора из 500 г 60 %-ного раствора кислоты:
m(H2O)=937,5 г-500 г =437,5 г.
Ответ: масса воды 437,5 г, масса раствора 937,5 г.
ПРИЛОЖЕНИЯ
| Приложение А Растворимость солей в воде | Катион | Pb2+ | М | М | Н | Р | Р | Н | Н | Р | Н | Н | Н | Н | Н | (Р – растворимое вещество, М – малорастворимое, Н- труднорастворимое; черта означает, что вещество не существует или разлагается водой |
| Sn2+ | Р | Р | Р | - | - | Н | - | Р | - | - | - | Н | Н | |||
| AI3+ | Р | Р | Р | Р | Р | - | - | Р | - | Н | - | Н | Н | |||
| Hg2+ | Р | М | Н | Р | Р | Н | Н | - | - | - | Н | Н | - | |||
| Zn2+ | Р | Р | Р | Р | Р | Н | М | Р | Н | Н | Н | Н | Н | |||
| Ba2+ | Р | Р | Р | Р | Р | Р | Н | Н | Н | Н | Н | Н | Р | |||
| Sr2+ | Р | Р | Р | Р | Р | Р | Р | Н | Н | Н | М | Н | М | |||
| Ca2+ | Р | Р | Р | Р | Р | Р | Н | М | Н | Н | М | Н | М | |||
| Mg2+ | Р | Р | Р | Р | Р | - | Н | Р | Н | Н | Р | Н | Н | |||
| Ag+ | Н | Н | Н | Р | Р | Н | Н | М | Н | - | Н | Н | - | |||
| Cu2+ | Р | Р | - | Р | Р | Н | Н | Р | - | - | Н | Н | Н | |||
| NH4+ | Р | Р | Р | Р | Р | Р | Р | Р | Р | - | Р | Р | Р | |||
| K+ | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | |||
| Na+ | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | |||
| Li+ | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | |||
| Анион | CI− | Br− | J− | NO3− | CH3COO− | S2− | SO32 | SO42- | CO32- | SiO32- | Cr042- | PO43- | OH− |
Приложение Б
 2017-11-01
2017-11-01 1245
1245
