1. У s - и р - элементов валентные электроны находятся на внешнем (или последнем) энергетическом уровне (ЭУ), а у d- элементов – на d- подуровне предпоследнего ЭУ и s-подуровне- последнего ЭУ.
2. p-, d-, f – АО сначала последовательно заполняются по одному электрону, а затем парными электронами: 1) ↑ ↑ ↑ 2) ↑↓ ↑↓ ↑↓
р р
3. В возбуждении атома участвуют парные электроны внешнего ЭУ. Сколько пар электронов во внешнем уровне, столько раз возбуждается атом, если в последнем ЭУ есть свободные валентные АО.
4. Максимальное число непарных электронов в р – подуровне – 3, d- подуровне – 5, f – подуровне – 7, а парных электронов: s2, p6, d10, f14
5. Конфигурация атома  его высшая степень окисления + 6. Высший оксид
его высшая степень окисления + 6. Высший оксид 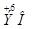
 ; низшая степень окисления: 6 – 8= – 2, водородное соединение
; низшая степень окисления: 6 – 8= – 2, водородное соединение  . У элемента 6 валентных электронов – находится в 6 группе.
. У элемента 6 валентных электронов – находится в 6 группе.
6. Провал электрона наблюдается у атомов следующих d-элементов: Cu, Ag, Au, Cr, Mo, Nb, Ru, Rh, Pd, Pt;
у Pd – провал двух электронов.
7. При ℓ → 0 электроны находятся в s- атомной орбитали (АО), ℓ → 1 – в р- АО, ℓ → 2 – в d- АО, ℓ → 3 – в f- АО.
 2017-11-01
2017-11-01 742
742








