Ионы некоторых элементов обладают способностью присоединять к себе полярные молекулы или другие ионы, образуя сложные комплексные ионы.







 4- Центральный атом
4- Центральный атом
 (комплексообразователь)
(комплексообразователь)


 Внешняя Лиганды
Внешняя Лиганды


 сфера К
сфера К 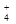 Внутренняя сфера
Внутренняя сфера
 |
Рисунок 1. – Схема строения K4[Fe(CN)6]
Соединения, в состав которых входят комплексные ионы, способные существовать как в кристаллическом состоянии, так и в растворе, называются комплексными соединениями.
Комплексные соединения образуются по донорно-акцепторному механизму.
В молекуле комплексного соединения различают следующие структурные элементы: ион–комплексообразователь (центральный атом), координированные вокруг него присоединенные частицы – лиганды, составляющие вместе с комплексообразователем внутреннюю координационную сферу, и остальные частицы, входящие во внешнюю координационную сферу. Ионы внешней сферы связаны с ионами внутренней сферы ионным типом связи, а лиганды с центральным атомом – ковалентным типом связи. Поэтому при растворении комплексных соединений лиганды остаются в прочной связи с ионом-комплексообразователем, образуя почти не диссоциирующий комплексный ион. Число сигма-связей, образованных центральным атомом с лигандами, называется координационным числом центрального атома (к.ч.).
На рисунке 1 приведена схема строения гексацианоферрата (II) калия K4[Fe(CN)6] – комплексного соединения, образующегося при взаимодействии: 4KCN + Fe(CN)2 = K4[Fe(CN)6].
При растворении комплексное соединение диссоциирует, участвуя в первичной диссоциации, на ионы внешней и внутренней сферы:
K4[Fe(CN)6] → 4K+ + [Fe(CN)6]4-.
Характерные комплексообразователи: Fe3+, Fe2+, Co3+, Cu2+, Ag+, Zn2+, Cr3+, Ni2+ (комплексообразователем могут быть атомы и ионы).
Характерные лиганды: CI−, Br−, NO2−, CN−, NH3, H2O (лигандами могут быть анионы и молекулы).
Заряд комплексного иона равняется алгебраической сумме зарядов составляющих его ионов. Например, заряд комплексного иона [Fe(CN)6]х- рассчитаем следующим образом: заряд иона Fe = +2, сумма зарядов 6 ионов CN− равна (-6). Отсюда: х = +2 – 6 = - 4.
Входящие в состав комплексного иона нейтральные молекулы не оказывают влияния на заряд комплексного иона.
Если все лиганды внутренней сферы являются нейтральными молекулами, то заряд комплексного иона равен заряду комплексообразователя.
Так, у иона [Cu(NH3)4]2+ заряд меди х=2+, поэтому заряд комплексного иона – 2+.
Заряд комплексного иона равен сумме зарядов ионов, находящихся во внешней сфере. В К4[Fe(CN)6] заряд [Fe(CN)6] равен -4, так как во внешней сфере находятся четыре иона К+ и их суммарный заряд равен 4+. Молекула любого комплексного соединения электронейтральна.
Пример. Вычислите заряды комплексных ионов, образованных платиной (IV): 1) [Pt(NH3)4CI2]; 2) [Pt(NH3)CI5]; 3) [Pt(NH3)2CI4].
Решение. Степень окисления атома платины равна +4, заряд молекул NH3 равен нулю, а заряд двух хлорид-ионов равен 2; алгебраическая сумма зарядов:
+ 4 + (-2) = +2.
Рассуждая подобным образ, найдем заряд других ионов:
2) +4 + (-5) = -1,
3) +4 + (-4) = 0.
В первом случае внешняя сфера содержит отрицательно заряженные ионы, во втором – положительно заряженные ионы, а в третьем – соединение практически является неэлектролитом.
 2017-11-01
2017-11-01 2463
2463
