Особенности репликации
1. Для эукариотических клеток характерно наличие множества точек начала репликации. Одновременное удвоение ДНК во многих участках значительно сокращает продолжительность всего процесса.
Точка начала репликации имеет специфическую последовательность оснований, богатую парами А – Т, что, вероятно, облегчает разделение цепей. Отрезок ДНК, репликация которого протекает под контролем одной точки начала репликации, образует репликон. В каждом репликоне присутствуют точка инициации (область начала репликации, от англ. replication origin – ori) и точка окончания (terminalis).
2. Репликация распространяется в обе стороны от каждой точки начала репликации. При этом образуются две репликативные вилки, движущиеся в противоположных направлениях (ранняя стадия репликации,
рис. 22). Между репликативными вилками появляется постепенно расширяющийся «глазок»: это уж реплицированные отделы ДНК. В итоге соседние зоны репликации («глазки») сливаются, и вся молекула ДНК оказывается удвоенной (поздняя стадия репликации, рис. 22).
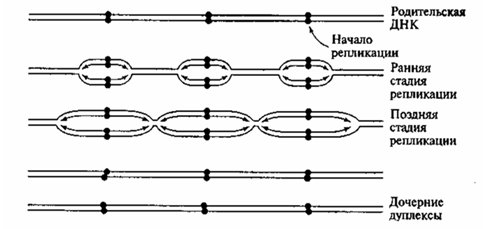
Рис. 22. Множественная двунаправленная репликация эукариотической ДНК
3. 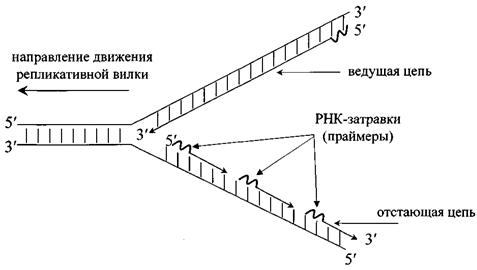 Движение репликативной вилки сопровождается одновременным считыванием двух матричных цепей. Поскольку синтез дочерних цепей ДНК осуществляется антипараллельно матричным и всегда в направлении 5′®3′, то лишь одна дочерняя цепь ДНК будет синтезироваться непрерывно. Эта цепь называется ведущей или лидирующей. Направление ее синтеза совпадает с направлением расплетания двойной спирали (рис. 23). На второй матричной цепи ДНК синтезируется сравнительно короткими фрагментами, названными фрагментами Оказаки (1000-2000 нуклеотидов у прокариот и 100-200 нуклеотидов в реплицирующейся ДНК эукариот). Синтез каждого фрагмента Оказаки также идет в направлении 5′®3′. В виде фрагментов Оказаки синтезируется та цепь, направление образования которой противоположно движению соответствующей репликативной вилки. Эта цепь называется отстающей или запаздывающей.
Движение репликативной вилки сопровождается одновременным считыванием двух матричных цепей. Поскольку синтез дочерних цепей ДНК осуществляется антипараллельно матричным и всегда в направлении 5′®3′, то лишь одна дочерняя цепь ДНК будет синтезироваться непрерывно. Эта цепь называется ведущей или лидирующей. Направление ее синтеза совпадает с направлением расплетания двойной спирали (рис. 23). На второй матричной цепи ДНК синтезируется сравнительно короткими фрагментами, названными фрагментами Оказаки (1000-2000 нуклеотидов у прокариот и 100-200 нуклеотидов в реплицирующейся ДНК эукариот). Синтез каждого фрагмента Оказаки также идет в направлении 5′®3′. В виде фрагментов Оказаки синтезируется та цепь, направление образования которой противоположно движению соответствующей репликативной вилки. Эта цепь называется отстающей или запаздывающей.
Рис. 23. Репликативная вилка
4. Образованию каждого нового фрагмента ДНК (как длинного фрагмента ведущей цепи, так и любого из фрагментов Оказаки отстающей цепи) предшествует синтез короткой последовательности РНК-затравки (праймера) из 10-15 нуклеотидов. Основной фермент, синтезирующий ДНК (ДНК-полимераза), не может начинать процесс «с нуля», а лишь достраивает 3′-конец уже имеющейся нуклеотидной последовательности. В противоположность этому, фермент ДНК-праймаза такой способностью обладает. Через некоторое время РНК-затравки удаляются и образовавшиеся бреши застраиваются ДНК-полимеразой. В дальнейшем все многочисленные фрагменты ДНК, образованные на одной родительской цепи, сшиваются специальным ферментом ДНК-лигазой в одну непрерывную цепь.
Процесс репликации осуществляется сложным ферментным комплексом, включающим 15-20 белков, которые условно разделяют на три группы.
1. Белки, подготавливающие родительскую ДНК к репликации
а) Узнающие (инициирующие) белки связываются со специфической последовательностью нуклеотидов в точке начала репликации и участвуют в присоединении к цепи ДНК всего комплекса ферментов репликации.
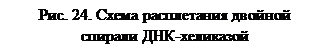
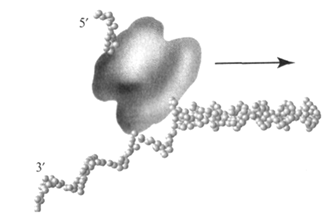 б) ДНК-хеликаза (от англ. helix – спираль) обеспечивает расплетание двойной спирали родительской ДНК в области репликативной вилки. Родительская ДНК разделяется на одноцепочечные участки, при этом затрачивается энергия гидролиза АТФ: 2 молекулы АТФ на разделение 1 пары нуклеотидов. Хеликаза, имеющая кольцевую структуру, однонаправленно перемещается по одной из цепей ДНК, расплетая перед собой двойную спираль, в результате чего возникает репликационная вилка (рис. 24). Вероятно, одновременно происходит вытеснение данного участка ДНК из связи с гистонами и другими хромосомными белками. Хеликазы часто функционируют в составе комплекса, осуществляющего перемещение репликативной вилки и репликацию расплетенных цепей.
б) ДНК-хеликаза (от англ. helix – спираль) обеспечивает расплетание двойной спирали родительской ДНК в области репликативной вилки. Родительская ДНК разделяется на одноцепочечные участки, при этом затрачивается энергия гидролиза АТФ: 2 молекулы АТФ на разделение 1 пары нуклеотидов. Хеликаза, имеющая кольцевую структуру, однонаправленно перемещается по одной из цепей ДНК, расплетая перед собой двойную спираль, в результате чего возникает репликационная вилка (рис. 24). Вероятно, одновременно происходит вытеснение данного участка ДНК из связи с гистонами и другими хромосомными белками. Хеликазы часто функционируют в составе комплекса, осуществляющего перемещение репликативной вилки и репликацию расплетенных цепей.
в) Белки, связывающиеся с одноцепочечной ДНК (SSB-белки – S ingle S trand B inding Proteins) обладают повышенным сродством к одноцепочечным участкам ДНК и стабилизируют их в таком состоянии. Роль SSB-белка в репликации, по-видимому, состоит в том, чтобы расправить ДНК и удалить возможные элементы вторичной структуры, которые могли бы образоваться в самокомплементарных участках ДНК. Связывание одноцепочечной ДНК с SSB-белком стимулирует ДНК-полимеразу и повышает точность ее работы.
г) Топоизомеразы. Каждая молекула ДНК зафиксирована в ядерном матриксе, поэтому она не может свободно вращаться при расплетании определенного участка. Это вызывает суперспирализацию (увеличивается количество оборотов на отрезке ДНК) и блокирует дальнейшее расплетание двойной спирали. Топоизомеразы решают названную топологическую проблему путем внесения одноцепочечных (топоизомераза I) или двухцепочечных (топоизомераза II) разрывов с последующим их восстановлением (рис. 25).
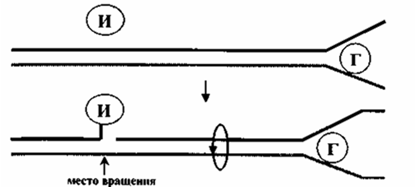
Рис. 25. Действие топоизомеразы I
2. Ферменты полимеризации
а) ДНК-праймаза синтезирует короткую РНК-затравку (праймер). ДНК-праймаза может быть отдельным ферментом (как у бактерий) или входить в качестве субъединицы в ДНК-полимеразу (как у α-ДНК-полимеразы эукариот). У некоторых прокариот (E. coli) праймаза образует комплекс с хеликазой, называемый праймосомой. Праймосома в свою очередь является компонентом еще более сложного комплекса – реплисомы, осуществляющей процесс полной репликации.
б) ДНК-полимеразы осуществляют комплементарное копирование одноцепочечной родительской ДНК. Про- и эукариотические ДНК-полимеразы несколько различаются по физическим и ферментативным свойствам, однако механизм их действия в общих чертах одинаков.
ДНК полимеразы прокариот разделяют на три типа – I, II и III (названия даны в порядке их открытия).
ДНК-полимераза I состоит из одного полипептида (молекулярная масса 109 кДа) и характеризуется:
- полимеразной активностью, т. е. осуществляет присоединение очередных нуклеотидов к строящейся цепи ДНК;
- 3 - экзонуклеазной (корректирующей) активностью, которая осуществляется в тех случаях, когда произошла ошибка и в строящуюся цепь включен «неправильный» нуклеотид. Тогда фермент отщепляет с растущего 3′-конца последний нуклеотид, после чего полимеризация восстанавливается;
- 5 - экзонуклеазной активностью, т. е. осуществляет последовательное отщепление нуклеотидов с 5′-конца РНК-затравки предшествующего фрагмента (рис. 26). Функция ДНК-полимеразы I исчерпывается, когда растущий фрагмент доходит до дезоксирибонуклеотидов предыдущего фрагмента.
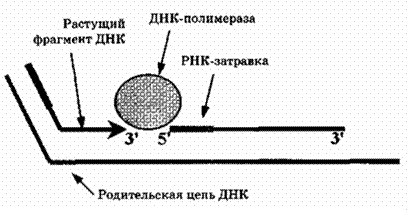
Рис. 26. ДНК-полимераза на «стыке» синтезируемых фрагментов
Фактически ДНК-полимераза I – это два фермента на одной полипептидной цепи: при мягком расщеплении этой ДНК-полимеразы трипсином можно получить большой и малый фрагменты с разными активностями. Большой фрагмент ДНК-полимеразы I (фрагмент Кленова) обладает полимеразной и 3'-экзонуклеазной (корректирующей) активностями, малый фрагмент несет 5'-экзонуклеазную активность (рис. 27). Подобные свойства ДНК-полимеразы I соответствуют ее функциям в клетке: эта полимераза удаляет различного рода дефекты в ДНК в ходе репарации и служит вспомогательной полимеразой при репликации ДНК, удаляя РНК-затравки. В целом ДНК-полимераза I имеет большее отношение к созреванию реплицирующейся ДНК, чем непосредственно к полимеразным процессам в репликативной вилке.

Рис. 27. Фрагменты полимеразы I
ДНК-полимераза II – одиночный полипептид с молекулярной массой около 120 кДа, обладающий полимеразной и 3'-экзонуклеазной активностями. Его содержание в клетке в несколько раз ниже, чемДНК-полимеразы I. Эта полимераза лучше всего работает на двуцепочечной ДНК с одноцепочечными брешами в несколько десятков нуклеотидов длиной. Предполагают, что основной функцией ДНК-полимеразы II является достраивание поврежденных участков в молекуле ДНК, т. е. репарация ДНК.
ДНК-полимераза III играет главную роль в репликации ДНК у бактерий. В каждой клетке содержится только 10-20 копий фермента, примерно столько же, сколько репликативных вилок. ДНК-полимераза III состоит из нескольких субъединиц (α, β, γ, δ, δ′, ε, θ и т. д. – всего около 10) и обладает полимеразной и 3'-экзонуклеазной активностями. Репликацию проводит полная форма фермента – холофермент, содержащий все субъединицы. Полимеразную реакцию осуществляет каталитический кор (ядро) из α-, ε-, θ-субъединиц, остальные усиливают его действие. Отличительная черта ДНК-полимеразы III – исключительно высокая процессивность (скорость и точность синтеза новой цепи).
В клетках эукариотических организмов обнаружены шесть ДНК-полимераз: α, β, δ, ε, γ, ζ, из них первые четыре непосредственно участвуют в репликации хромосомной ДНК.
3. Ферменты, завершающие репликацию ДНК
а) ДНК-лигаза осуществляет «сшивание» соседних фрагментов ДНК, образуя межнуклеотидную (фосфодиэфирную связь). Реакция сопряжена с гидролизом молекулы АТФ.
б) Теломераза участвует в репликации теломерных (концевых) участков линейной ДНК.
ДНК-полимеразная система, описанная выше, оставляет недореплицированными 3′-концы материнских цепей ДНК, т. е. новые цепи оказываются укороченными с 5′-концов (рис. 28). Пропуск, образовавшийся после удаления крайнего праймера на 5′-конце дочерней цепи ДНК, заполнен быть не может, поскольку любая из полимераз не способна действовать «с нуля», а лишь удлиняет 3′-конец имеющегося полинуклеотида. В результате выступающие 3′-концевые участки материнской цепи ДНК остаются однотяжевыми, недореплицированными. Подобные концы ДНК называют острыми, или оверхенгами. Каждый раунд репликации ДНК будет приводить к ее укорочению на 50-60 нуклеотидов.
На концах линейных хромосом эукариот находятся специализированные ДНК-белковые структуры – теломеры. У большинства организмов теломерная ДНК представлена многочисленными короткими повторами (у млекопитающих – ТТАГГГ), не несущими генетической информации. Поэтому, если происходит потеря некоторой части данных повторов, это не отражается на функционировании генома. В этом состоит, вероятно, основная функция теломер: они предохраняют от недорепликации более значимые области ДНК, т. е. выполняют роль своеобразного буфера.
Однако теломерные участки ДНК имеют и ряд специальных функций (участвуют в фиксации хромосом к ядерному матриксу, влияют на экспрессию генов и др.), поэтому их укорочение допустимо лишь до некоторого предела. Синтез теломерных участков, утраченных в результате «концевой недорепликации», осуществляет фермент теломераза. К 3′-концу родительской цепи теломераза последовательно достраивает несколько десятков или сотен повторов ТТАГГГ. Таким образом, фермент удлиняет не дочернюю укороченную цепь, а родительскую – более длинную (рис. 28). Роль матрицы для наращивания ДНК повторами выполняет РНК, связанная с теломеразой. Следовательно, теломераза выступает как обратная транскриптаза – фермент, осуществляющий синтез ДНК на РНК-матрице.

Рис. 28. Схема репликации теломерного участка ДНК с участием теломеразы
Значительно удлиненная родительская цепь становится способной выступать в качестве матричной для образования еще одного фрагмента Оказаки дочерней цепи. При этом репликация идет в обычном порядке: праймаза синтезирует РНК-затравку, ДНК-полимераза последовательно присоединяет к затравке дезоксирибонуклеотиды – комплементарно теломерным повторам родительской цепи. Рост фрагмента происходит в обычном направлении 5′®3′. «Сшивание» фрагмента с цепью осуществляет ДНК-лигаза, экзонуклеаза удаляет РНК-затравку на новой цепи. В итоге конец двухцепочечной ДНК приобретает ту же конфигурацию, что и до действия теломеразы (дочерняя цепь немного короче старой), однако становится длинней на серию теломерных повторов. Это основной способ восстановления длины теломер, обнаруженный практически у всех исследованных организмов.
Высокая теломеразная активность наблюдается в эмбриональных тканях, стволовых и половых клетках (табл. 2). При дифференциации зародышевых или стволовых клеток активность теломеразы падает и теломеры укорачиваются. С достижением критической величины теломерной ДНК запускаются процессы остановки клеточного цикла. Дифференцированные клетки делятся ограниченное число раз. Это явление получило название «лимита Хейфлика».
 2013-12-29
2013-12-29 3824
3824
