У многих паразитов обнаружены ферменты, изменяющие структуру фитоалексинов и фитоантиципинов и снижающие их токсичность. Известно несколько групп таких ферментов.
Гликозидазы. Эти ферменты отщепляют глюкозу и другие сахара от гликозида, переводя его в нерастворимую форму аглико-на. Например, штаммы возбудителя корневой гнили злаков Geumannomyces graminis, способные заражать корни овса, отличаются от авирулентных штаммов наличием фермента авенаци-назы, отщепляющей остатки Сахаров от сапонина авенацина и переводящей его в нерастворимую менее активную форму.
Томатиназа (Р -гликозидаза) паразита томата Septoria lycopersici, отщепляя глюкозу от стероидного гликоалкалоида а-томатина, переводит его в более токсичный р2-томатин. Последний, в свою очередь, подавляет индукцию защитной ответной реакции, поскольку интерферирует с фундаментальными путями передачи сигнала, ведущими к возникновению устойчивости.
Гидролиазы. Изменяют молекулу присоединением к ней воды. Например, патогены сорго Gloeosporium sorghi и лядвенца Stemphylium loti с помощью фермента цианидгидролиазы осуществляют конверсию цианида (синильной кислоты) в менее токсичный формамид.
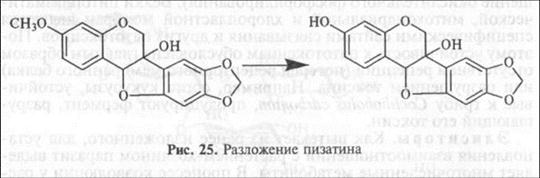
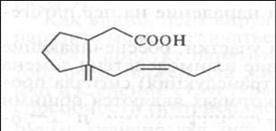
Деметилазы. Отщепление от некоторых соединений метальных групп сильно снижает их патогенность. Например, штаммы гриба Nectria haematococca (анаморфа Fusarium solani), способные заражать горох, имеют фермент пизатиндеметилазу, отщепляющую метальную группу от молекулы пизатина (рис. 25).
Импедины. В отличие от вивотоксинов, которые разрушают растительную ткань, молекулы супрессоров импединов лишь предотвращают появление устойчивости, позволяя патогенным орга-
низмам колонизировать растение. Супрессоры вирулентных к данному растению видов и штаммов патогенов так воздействуют на растительные клетки, что они теряют способность противостоять последующему заражению невирулентными штаммами и видами. В частности, пептидный супрессор паразита гороха Mycosphaerella pinodes ингибирует индукцию в листьях гороха стрессовых ферментов ФАЛ и халконсинтетазы и накопление фи-тоалексина пизатина. Супрессор Phytophthora infestans — р-глюкан, выделяемый вирулентными расами, ингибирует образование раневой перидермы в клубнях восприимчивых сортов картофеля и накопление фитоалексинов. Именно по этой причине партии клубней картофеля с высоким процентом зараженности фитофто-розом обычно сгнивают не от этой болезни, а от болезней, вызываемых некротрофными гнилостными грибами и бактериями, защиту от которых снимают супрессоры фитофторы.
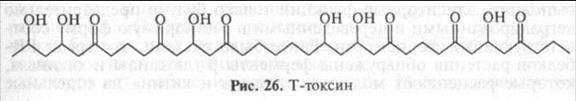
Патотоксины. В отличие от вивотоксинов некоторые токсины фитопатогенных грибов оказывают повреждающее действие только на определенные виды и даже сорта растений. Они получили название патотоксинов. Например, линейный поликетид (рис. 26) — токсин гриба Cochliobolus heterostrophus (анаморфа Bipolaris maidis) вызывает очень сильное поражение только таких сортов кукурузы, в которые для получения высокоурожайных гибридов введен ген цитоплазматической мужской стерильности (цмс), локализованный в митохондриях. Этот ген контролирует синтез белка с молекулярной массой 13 кД (URF13), локализованного на внутренней мембране митохондрий и являющегося мишенью действия токсина. В соединении с токсином белок URF13 полимеризуется и образует трансмембранные каналы, через которые происходит утечка метаболитов (потери Са2+, НАД+, разоб-
щение окислительного фосфорилирования). Белки цитоплазма™ -ческой, митохондриальной и хлоропластной мембран являются специфическими сайтами связывания и других патотоксинов. Поэтому устойчивость к патотоксинам обусловлена главным образом отсутствием рецепции (потерей рецепторного мембранного белка) или разрушением токсина. Например, сорта кукурузы, устойчивые к грибу Cochliobolus carbonum, продуцируют фермент, разрушающий его токсин.
Эли сито ры. Как вытекает из ранее изложенного, для установления взаимоотношений с растением-хозяином паразит выделяет многочисленные метаболиты. В процессе коэволюции у растений возникли механизмы рецепции некоторых метаболитов паразитов и передачи сигнала о появлении чужого организма для инициации защитных реакций. Вещества паразита, индуцирующие протекание защитных реакций у растений, получили название элиситоров. Как и иммуносупрессоры, элиситоры бывают неспецифическими, вызывающими протекание защитных реакций как в устойчивых, так и в восприимчивых видах и сортах растений, и специфическими, которые вызывают защитные реакции только в устойчивых сортах растений.
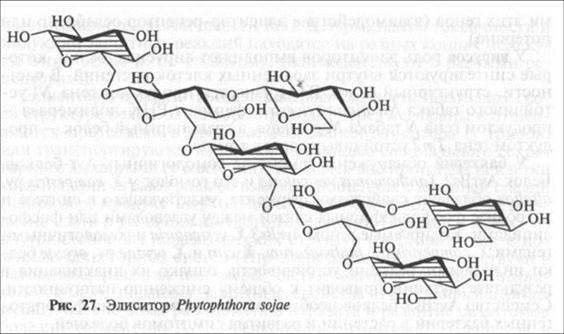
Неспецифические элиситоры. Первые этапы взаимодействия паразитов с растениями обусловлены контактами клеточной стенки гриба или бактерии с цитоплазматической мембраной растительной клетки. Поэтому многие компоненты клеточной стенки грибов обладают элиситорными свойствами, вызывающими защитную ответную реакцию растения. Основные составные части грибной клеточной стенки р-1,3-глюкан и линейный полимер ацетилглюкозоамина хитин. Обрывки этих молекул — олигосахариды являются хорошо исследованными элиситорами. Например, обработка семядолей сои гептаглюкозидом (олигомер, состоящий из семи глюкозных остатков) Phytophthora sojae (рис. 27) в концентрации 10 нМ индуцирует образование в них фитоалексина глице-оллина. Из плазмалеммы сои выделен белок-рецептор, связывание которого с глюкозидом приводит к изменению ионных каналов мембраны, потере К+ и СЛ и, наоборот, повышенному поступлению Са2+ и Н~, генерации активных форм кислорода, активизации иммунной реакции клетки. Активными элиситорами являются хитин, его деацетилированная форма хитозан и их фрагменты (олигомеры), а также гликопротеиды, входящие в состав клеточных стенок грибов. Полисахариды клеточных стенок грибов — высокомолекулярные соединения, ковалентно связанные друг с другом и другими соединениями, поэтому они могут выполнять элиситорные функции только будучи предварительно деградированными и переведенными в растворимую форму соответствующими ферментами. Ранее было сказано, что среди PR-белков растения обнаружены ферменты Р -глюканаза и хитиназа, которые расцепляют молекулы глюкана и хитина на отдельные
низкомолекулярные фрагменты, проникающие в растение и играющие роль элиситоров.
Элиситорной активностью обладают и некоторые внутриклеточные соединения фитопатогенов. Например, в клетках Phytophthora infestans содержится полиненасыщенная жирная а р а -хидоновая кислота, содержащая четыре двойные связи (рис. 28). Она освобождается из проростков спор и вызывает протекание активных защитных реакций в зоне заражения, в частности накопление фитоалексинов.
Расоспецифические элиситоры. Вернемся к квадратной сетке, описывающей диаллельные взаимоотношения растения-хозяина и паразита в системе «ген-на-ген» (см. табл. 3). Устойчивое состояние (несовместимость) развивается только в том случае, если комплементарные гены хозяина и паразита находятся в доминантном состоянии. Если же один из них или оба гена рецессивны, то растение восприимчиво, а паразит вирулентен (состояние совместимости). Эти данные были интерпретированы следующим образом: ген устойчивости R-ген контролирует синтез специфического белка-рецептора, а ген авирулентности (Avr-ген) — специфического элиситора. Их взаимодействие приводит к индукции защит ных реакций. Если у растения отсутствует рецептор или у паразита элиситор, то защитная реакция не развивается. Отсутствие рецепции может быть вызвано делецией генов хозяина и паразита (рецептора или элиситора нет вообще) или мутация
ми этих генов (взаимодействие элиситор-рецептор ослаблено или потеряно).
У вирусов роль элиситоров выполняют вирусные белки, которые синтезируются внутри зараженных клеток растений. В частности, структурный белок ВТМ узнается продуктом гена N' устойчивого табака Nicotiana sylvestris, фермент РНК-полимераза — продуктом гена 7Vтабака N. glutinosa, а транспортный белок — продуктом гена Тт2 устойчивых сортов томата.
У бактерий обнаружены семейства гомологичных Avr-белков. Белок AvrBs2 Xanthomonas vesicatoria и его гомолог у X. campestris pv. alfalfae обладают свойствами фермента, участвующего в синтезе и гидролизе фосфодиэфирных связей между углеводами или фосфо-липидами. Кодируемые геном AvrBs3 X. vesicatoria и гомологичными генами X. campestris pv. malvacearum, X. citri и X. oryzae pv. oryzae белки индуцируют реакции устойчивости, однако их инактивация в результате мутаций приводит к общему снижению патогенности. Семейство АугВвЗ-белков необходимо для размножения фитопато-генных бактерий в растении и развития симптомов болезней.
Установлена структура Avr-белков и у некоторых грибов. Белок Avr9 Cladosporium fulvum, вызывающий защитные реакции у сортов томата, имеющих ген Cf9, представляет собой пептид из 28 аминокислот, накапливающийся в межклеточной жидкости пораженных листьев. Функции Ауг9-белка неизвестны, но, по-видимому, он участвует в поступлении азота, так как синтезируется в зараженных растениях, a in vitro только в условиях азотного голодания. Регулятором его активности является белок Nrfl — центральное звено в поступлении и метаболизме нитратного азота у гриба.
У гриба Pyricularia oryzae (телеоморфа Magnaporthe grized) установлена структура нескольких ду/--генов и кодируемых ими белков. Ген AVR-Pita локализован в теломерной области хромосомы, что обусловливает его нестабильность вследствие частых перестроек. (Нестабильность вирулентных рас этого гриба давно вызывала удивление фитопатологов; есть данные, что из одного пятна можно изолировать много моноспоровых штаммов, различающихся вирулентностью на сортах риса.) Элиситор Avr-Pita состоит из 176 аминокислот. Функционально он представляет собой цинкзависимую протеазу. Ген AVR-Pita экспрессируется на поздних этапах патогенеза, что связано, по-видимому, с необходимостью использовать находящиеся в зараженной клетке белки для питания. Другой avr-белок — Acel оказался ферментом полике-тидсинтетазой, участвующей в синтезе вторичных метаболитов поликетидной структуры (в частности, меланина).
Возбудитель пятнистости ячменя гриб Rhinchosporium secalis выделяет в растение несколько белков, вызывающих некрозы, и названных NIP-белками. Они неспецифически токсичны для разных растений, то есть являются вивотоксинами. Один из них — NIP1 оказался расоспецифическим элиситором для сортов ячменя, имеющих ген устойчивости Rrsl. Детерминанты токсичности и индукции защитных реакций находятся на разных концах молекулы этого белка и, по-видимому, взаимодействуют с разными рецепторами.
Элиситоры и паразитическая приспособленность. Благодаря своей структуре белки-элиситоры проходят через мембраны и отщепляются протеазами в процессе созревания элиситора (у грибов) или транспортируются из клетки с помощью специального секреторного механизма (у бактерий). Находясь вне протопласта клетки хозяина, они играют роль во взаимоотношениях с внешней средой (например, продукт avr9 Cladosporium fulvum участвует в метаболизме азота в условиях азотного голодания). Попадая в клетку из внутриклеточных паразитических структур (гаусторий) или с помощью секреторных систем (Hrp-пили бактерий), они участвуют в патогенезе, разлагая полимеры клетки хозяина (AvrPi-ta Magnaporthe grisea), подавляя защитные свойства (NIP1 Rhinchosporium secalis), обеспечивая размножение паразита и развитие симптомов болезни (семейство АугВЗ-белков у ксантомонад). У вирусов в роли специфических элиситоров выступают внутриклеточные белки, как структурные, так и ферментные.
Приспособленностью или фитнесом (по-английски fitness, W) называют вклад индивидуума в генный пул следующей генерации (Roughgarden, 1979). Фитнес популяции за какой-либо отрезок времени равен отношению (г) численностей за это время (In W= г). Если популяция представлена одним клоном, то фитнес всех ее членов будет одинаковым. Однако реальные популяции состоят из генотипов, имеющих различный фитнес. Разница между фитнесом лучшего генотипа и средним фитнесом популяции называют генетическим грузом (L). Груз может быть сегрегационным и мутационным. Первый обусловлен преимуществом гетерозигот, при размножении которых выщепляются гомозиготы с более низким фитнесом. Поскольку большинство фитопатогенов гаплоидны, причем многие из них агамны, вклад сегрегационного груза в общую приспособленность невелик.
Мутационный груз обусловлен непрерывным спонтанным мутационным процессом, вследствие которого возникают мутанты с пониженным фитнесом. Допустим, что в популяции встречается два аллеля одного локуса — нормальный А и мутантный а. Приспособленность первого WA = 1, а второго Wa = 1 — S, где S— коэффициент отбора (показатель мутационного груза). Если частота дикого фенотипа равна р, а мутантного — q (р + q = I), то средняя приспособленность популяции будет равной 1 — Sq. При значении S выше, чем q, мутантные фенотипы не будут накапливаться в популяции. Общее число мутантов (q) будет слагаться из частоты мутаций А —> а и коэффициента отбора против мутантного фенотипа (S). Следовательно q = m/S(l + т), где т — частота мутантного генотипа. Поскольку т — очень малая величина, 1 + т = 1, q т m/S, z.S~m/q. Следовательно, зная частоту мутантного генотипа и частоту мутаций, можно вычислить S.
Поскольку расширение вирулентности сопровождается потерей или изменением структуры элиситора, оно сопровождается снижением приспособленности в паразитической или сапрофитной фазе жизненного цикла паразитов. В эпидемиологии есть даже понятие «цена вирулентности» (Leonard, 1977). В таблице 3 (с. 61) изображены диаллельные взаимоотношения паразита и растения-хозяина в системе «ген-на-ген». Если эти же взаимоотношения выразить не в качественных, а в количественных (популяционных) показателях, то они примут следующий вид (табл. 4).
4. Фитнес паразитов на разных хозяйских генотипах в системе «ген-на-ген»

Показатель устойчивости сорта t можно вычислить, сравнивая интенсивность размножения паразита на устойчивом и восприимчивом сортах. По многим данным / приближается к 1, а 1 — / приближается к 0. S— цена вирулентности, то есть налог, который выплачивает паразит за способность размножаться на- устойчивом генотипе хозяина. Методы его расчета различны (Дьяков, 1998). Некоторые показатели S (Ennos, McConnell, 1995) приведены ниже:
Puccinia graminis avenae — 0,126 (против лишних генов вирулентности);
P. striiformis— 0,435 (против вирулентной расы);
Cochliobolus heterostrophus — 0,302 (против расы 0 на Г-цито-плазме), 0,120 (против расы Г на нормальной цитоплазме);
С. carbonum — 0,58 (против расы 0), 0,17 (против расы 3);
Phytophthora infestans — 0,622 (против гена вирулентности расы I).
Как видно, цена вирулентности разных генов одного и того же паразита может отличаться.
Если продукт паразита, который растение узнает как элиси-тор, очень важен для жизнеобеспечения (fitness), то его потеря или изменение структуры может трагически сказаться на жизнеспособности (интенсивности споруляции, патогенности, способности сохраняться вне растения) и численность вирулентной расы будет невысокой. В таких случаях ВУ, несмотря на теоретическую возможность ее преодоления вирулентными расами, будет долгое время оставаться стабильной. Например, найдено много штаммов ВТМ, поражающих вид табака Nicotiana sylvestris, потому что изменения в структуре белка оболочки вируса, при которых он перестает узнаваться как элиситор, не сказываются на жизнеспособности вируса. Однако N. glutinosa и гибриды с ним культурного табака много лет сохраняют устойчивость к вирусу, хотя их посевы занимают значительные площади. Это связано с тем, что элиситор для них — фермент РНК-полимераза вируса, изменения структуры которого ухудшают его работу и сильно снижают fitness.
СТРУКТУРА R-БЕЛКОВ РАСТЕНИЙ. Химическая структура продуктов генов ВУ — R-белков была расшифрована лишь в конце прошлого века. Эти белки содержат несколько участков (доменов). Поскольку белки являются полимерами аминокислот, они заканчиваются с одной стороны карбоксильной группой (С-концевой участок), а с другой — аминогруппой (N-концевой).
Самый крупный домен находится на С-конце белка. Он содержит большое число (несколько десятков) повторяющихся последовательностей аминокислот, среди которых чаще других встречается аминокислота лейцин (повторы, богатые лейцином — ПБЛ). Каждый ПБЛ состоит из 23...24 аминокислот; во-первых, такая структура обеспечивает взаимодействие с другими белками, то есть может служить рецептором для лигандов (элиситоров) паразита, и, во-вторых, наличие частых повторов в структуре кодирующей ДНК (Л-гене) является условием генетических перестроек вследствие неаллельной (эктопической) рекомбинации. Частые внутри- и межгенные перестройки, включающие неравный кроссинговер, приводят к возникновению серии аллельных и тесно сцепленных генов. Их продукты отличаются деталями структуры рецепторных участков и могут связываться с разными по химической структуре элиситорами. Таким образом устанавливаются расоспецифические взаимоотношения, описываемые как система «ген-на-ген». Молекулярные исследования показали, что домен ПБЛ в большинстве случаев соединяется не непосредственно с элиситором. Сначала элиситор, будучи фактором неспецифической патогенности, соединяется с определенными молекулами в зараженной клетке, блокируя иммунные реакции. ПБЛ домен R-белка узнает такое соединение, то есть он стоит на страже клетки, предотвращая нападение на нее патогенов.
На N-конце R-белка располагаются участки, обеспечивающие передачу сигнала, возникшего вследствие взаимодействия домена ПБЛ с элиситором. Распространение (трансдукция) сигнала протекает несколькими путями, часть из которых являются общими для всех зараженных клеток, а часть — специфичными (по отношению к биотрофным паразитам преобладает один путь, к не-кротрофным и насекомым-вредителям — другой, к ризосферным бактериям — третий). Кратко рассмотрим некоторые пути транс-дукции сигнала в клетках и вещества, участвующие в этом процессе.
• Протеинкиназный путь. Функция ферментов протеинкиназ заключается в фосфорилировании определенных белков. Поскольку остатки фосфорной кислоты —• высокоэнергетические соединения, фосфорилированный белок приобретает определенную активность, которой он не имел прежде. Кроме того, этот белок может дефосфорилироваться, передавая фосфат другому белку. Возникает цепочка, по которой фосфат передается внутрь клетки, при этом сигнал может многократно усиливаться. Конечная кина-за имеет участок (сайт), связывающийся с ДНК, вследствие чего может включать транскрипцию ранее молчащих генов или, наоборот, выключать другие гены (белок — регулятор транскрипции). В результате происходит включение генов иммунного ответа, обеспечивающих синтез PR-белков, фенолов, фитоалексинов и других факторов индуцированной устойчивости. Если такие белки представить себе в виде игроков футбольной команды, то нефос-форилированный белок, как и игрок без мяча, неактивен, а фосфорилированный — активен. Передача фосфата от одного белка другому — это перепасовка мяча, приближающая его к воротам соперника. Наконец, фосфорилирование белка — регулятора транскрипции — это передача мяча нападающему, который забивает гол. В клетках всех эукариот имеется семейство протеинкиназ, активность которых увеличивается во время митозов (мито-ген-активных протеинкиназ или МАП-киназ). Их цепочка — один из важных путей трансдукции сигнала в зараженной клетке.
• Роль салициловой кислоты в трансдукции сигнала. Простое фенольное соединение салициловая кислота (рис. 29) является важным пунктом передачи сигнала, ибо участвует в регулировании СВЧ-реакции, синтезе феноль-ных соединений, PR-белков и, что очень важно, в возникновении системной приобретенной устойчивости (СПУ). Интересно,
Рис. 29. Салициловая кислота что ацетилированное производное
Что ацетилированнае производство салициловой кислоты — аспирин — самое распространенное лекарство, которое активно влияет на протекание иммунных реакций у человека.
• Роль жасмоновой кислоты и этилена в трансдукции устойчивости. Одно из важных изменений, протекающих после активации R- белка
Рис. 30. Жасмоновая кислота текающих
элиситором паразита — усиление липидного обмена, в частности, активизация фермента липооксигеназы (ЛОГ). Продукты окисления липидов — оксилипины, один из которых жасмоновая кислота (ЖАК) (рис. 30)^.является важным промежуточным элементом трансдукции сигнала, особенно при заражении некротрофными паразитами или питании насекомыми. ЖАК и ее метиловый эфир (Ме-ЖАК) индуцируют образование группы так называемых жасмонатиндуцируемых белков — ингибиторов протеиназ тионинов, фениаланинаммиаклиазы, халконсинтетазы, липооксигеназы. Эти белки, как было сказано, являются факторами защиты от патогенных микроорганизмов и насекомых-фитофагов. Сходным действием обладает и газообразный растительный гормон этилен.
Таким образом, зараженная клетка имеет много различных путей доставки сигнала о появлении чужеродного организма к ядру и активизации ответной иммунной реакции.
4.2.2. ГОРИЗОНТАЛЬНАЯ УСТОЙЧИВОСТЬ
Как было сказано, горизонтальная устойчивость (ГУ) отличается от вертикальной тем, что она расонеспецифична и отношения паразита и хозяина типа «ген-на-ген» при ней отсутствуют или неотчетливы. Различия между этими формами проявляются также в генетическом контроле. При скрещивании сортов, обладающих ВУ, с восприимчивым потомством F\ дает единообразную реакцию на заражение (чаще оно устойчиво, так как гены ВУ доминантны), в F2 наблюдается обычно расщепление на два класса, четко различающихся по фенотипу, — устойчивых и восприимчивых. Соотношение численности этих классов дает возможность определить число генов устойчивости у устойчивого родителя.
Если же скрестить сорт, обладающий ГУ, с восприимчивым, то в первом поколении не будет фенотипического разнообразия. Так, при скрещивании двух контрастных по устойчивости к фито-фторозу сортов картофеля Вольтман и Приекульский ранний [первый — устойчив и поражается на 1 балл по пятибалльной шкале (0 —нет поражения, 4 —гибель растения, 1...3 — промежуточные показатели), второй сорт восприимчив и поражается на 3...4 балла] гибридное потомство этих сортов будет иметь различное поражение, как сильное, так и слабое, поэтому составить представление о доминантности и рецессивности генов устойчивости сорта Вольтман трудно. В таких случаях проводят статистический анализ расщепляющегося потомства. При построении графика зависимости степени пораженности отдельных растений от их числа в расщепляющейся гибридной популяции получается следующая картина (рис. 31). Как видно, в гибридном потомстве присутствуют как устойчивые, так и восприимчивые экземпляры, но у боль шинства
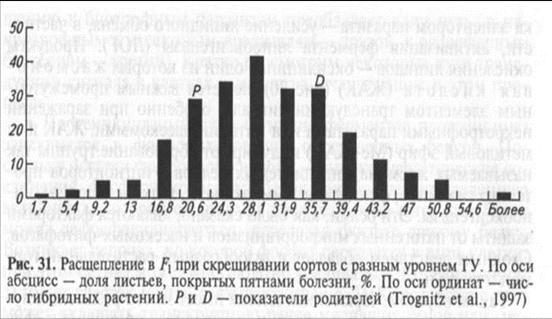
растений пораженность соответствует среднему баллу. Гены, у которых отсутствует аллельное взаимодействие (частичная или полная доминантность), а гибриды показывают промежуточный фенотип по сравнению с их родителями, называют аддитивными. Во втором поколении колоколообразная кривая расщепления будет еще более растянутой, так что и о числе генов по результатам расщепления судить не приходится. Различия между сортами Вольтман и Приекульский ранний заключаются лишь в числе аддитивных генов. Эти гены обладают слабой экспрессивностью, то есть носитель каждого гена придает малозаметное фенотипическое отличие от носителя его аллеля, но в сумме они имеют кумулятивный эффект: чем больше генов, тем выше устойчивость. Допустим для простоты, что каждый ген снижает пора-жаемость фитофторозом на 0,5 балла. Тогда при отсутствии генов устойчивости растения будут поражены на 4 балла, при наличии одного гена — на 3,5, двух — на 3, трех — на 2,5, четырех — на 2, пяти — на 1,5, шести — на 1, семи — на 0,5 и восьми — на 0 баллов. В таком случае сорт Вольтман будет иметь 6 генов устойчивости (1 балл поражения), а сорт Приекульский ранний — 2 гена (3 балла). Если шесть генов сорта Вольтман и два гена сорта Приекульский ранний разные, то в гибридном потомстве возможно появление растений, имеющих от 0 до 8 генов, то есть более устойчивых, чем устойчивый родитель, и более восприимчивых, чем восприимчивый (такое явление называют трансгрессией, которая является основой получения устойчивых гибридов при скрещивании среднеустойчивых сортов в селекционном процессе). Но таких растений в потомстве будет мало и для их выделения потребуется оценить очень большую гибридную популяцию. Так, гомозиготное растение, сочетающее шесть генов родителей, может возникнуть, в среднем, одно в более чем 6 тыс. гибридов, 5 генов — в тысяче гибридов, 4 гена — одно в 256 растениях. Большинство же
потомков будет поражено на средний балл (6 генов сорта Вольтман + 2 гена сорта Приекульский ранний)/2) = 4 гена, или пораженность на 2 балла.
Из приведенного примера также следует, что в отличие от ВУ, придающей растению четкую качественную реакцию на заражение (СВЧ), ГУ может быть количественна и неодинакова у разных сортов (не тип пятна, а его размеры и число на растении).
Поскольку ГУ не подвергается эрозии со стороны вирулентных рас, она представляет большой интерес для селекции.
Гены ГУ, как и гены ВУ, у многих растений не рассеяны по хромосомам, а собраны в тесно сцепленные группы (кластеры), которые называют локусами, влияющими на количественные признаки — quantitative trait loci (QTL). По результатам гибридизации можно определить примерное число таких локусов.
С развитием методов анализа ДНК появилась возможность картировать локу-сы, влияющие на количественные признаки, с помощью комбинации молекулярных и фенотипически проявляющихся показателей. Для этого скрещивают сорта или виды растений, имеющие отчетливое фенотипическое проявление количественного признака (например, ГУ), с сортами или даже близкородственными видами, для которых составлены достаточно подробные генетические карты, и изучают расщепление в потомстве по этому признаку параллельно с расщеплением по большому числу молекулярных маркеров (RAPD, RFLP, SCAR), с помощью которых строят генетические рестрикционные карты. Анализ сцепления устойчивости в расщепляющемся гибридном потомстве (F2 — /4, ВС) с определенным молекулярным маркером на хромосомном участке позволяет, используя статистические методы оценки коэффициента ассоциации, локализовать QTL на рестрикционной карте. Например, на рисунке 32 представлена рестрикционная карта 5-й хромосомы картофеля с нанесенными на нее QTL устойчивости к фито-фторозу, полученными разными исследователями (обозначены различными значками) у разных видов Solanum. Как видно, на этой хромосоме выявлено четыре QTL: два — ближе к дистальной части хромосомы (сцеплены с молекулярными маркерами GP186 и GP21) и два —ближе к проксимальной области (сцеплены с GP113 и TG69). Интересно, что область, в которой QTL локализован различными исследователями при анализе разных образцов устойчивых пасленовых, тесно сцеплена с геном ВУ R1. Выявлены QTL, которые контролируют устойчивость клубней и листьев, только листьев, связанные с позднеспелостью и т. п.
Хотя для анализа QTL необходимо сложное молекулярное лабораторное оснащение, его результаты перекрывают затраты на его проведение, ибо такой анализ дает много полезной информации для генетиков и селекционеров:
• позволяет установить локализацию полигенов на генетической карте;
• дает возможность оценить эффекты отдельных QTL и их совместное действие (эпистаз), зависимость генетических эффектов от внешних условий (взаимодействие генотипа и среды);
• дает интегрированные знания о генетической сложности признака и снабжает селекционера полезной информацией о путях непрямой селекции (отбора желаемых генотипов в расщепляющемся потомстве по молекулярным маркерам);
• облегчает перенесение (интрогрессию) нужных генов из диких видов, примерно в 2 раза сокращая число беккроссов для создания изогенных линий.


 2013-12-31
2013-12-31 867
867








