ВЕРТИКАЛЬНАЯ И ГОРИЗОНТАЛЬНАЯ УСТОЙЧИВОСТЬ
Кроме перечисленных в начале главы еще одно важное отличие генетического контроля устойчивости к болезням от контроля других хозяйственно ценных признаков — необходимость защиты от разных видов и внутривидовых вариаций патогенных организмов. Устойчивость к каждому патогену может находиться под собственным генетическим контролем, что приводит к наличию огромного числа генов, непосредственно связанных с устойчивостью к болезням. У растения Arabidopsis thaliana семейства крестоцветных, геном которого полностью секвенирован, обнаружено более 100 генов устойчивости. При этом история фитопатологии свидетельствует о том, что устойчивость многих сортов может со временем быть потеряна вследствие накопления вирулентных для них рас паразитов. Другие сорта, наоборот, сохраняют свою устойчивость неопределенно долго (их устойчивость стабильна). Известный фитопатолог Вандерпланк назвал устойчивость, которая не теряется вследствие наличия вирулентных рас, горизонтальной или латеральной, а устойчивость, которая может преодолеваться вирулентными расами патогенов, — вертикальной или перпендикулярной. Как видно из изложенного ранее, полевая устойчивость почти всегда горизонтальна (ведь если инфекционная капля быстро высыхает или скатывается с листа, то пораженность растения будет низкой независимо от свойств того или иного штамма паразита). Истинная устойчивость может быть вертикальной или горизонтальной.
фенотипическое проявление вертикальной устойчивости. Наиболее частое внешнее проявление вертикальной устойчивости (ВУ) — быстрая гибель зараженных тканей, органов или клеток, называемая реакцией сверхчувствительности (СВЧ). Известно несколько форм СВЧ.
• Верхушечный некроз. При этой форме СВЧ гиперчувствительностью обладает только меристема. Некоторые сорта картофеля (например, Кинг Эдуард) системно заражаются вирусом X (ХВК), но как только вирусные частицы достигают меристемы, она погибает, а с ней и все зараженное растение. Поэтому такие сорта не нуждаются в противовирусных прочистках; их клубни всегда свободны от ХВК.
• Самоотторжение. Листья некоторых сортов перца, зараженные штаммами ВТМ, и фасоли, зараженные штаммами Pseudomonas syringae, обеспечивают распространение инфекции по листу до того места, где он сочленяется с черешком (листовая пяточка). Эти клетки обладают гиперчувствительностью, вследствие чего зараженный лист опадает, как при осеннем листопаде.
• Дырчатая пятнистость. В листьях некоторых косточковых пород (вишни, сливы, абрикоса) грибная и бактериальная инфекция индуцирует образование слоя раневой перидермы, кольцом окружающей зараженное место. Зараженная ткань выпадает, и образуется дырка. У некоторых растений, например у конского щавеля, такие дырки окружены красным кольцом вследствие отложения фенольных пигментов антоцианинов (активизация фенольного метаболизма в ответ на заражение).
• Локальный некроз. Это самая распространенная форма СВЧ. Он выражается в почернении (некрозе) или, реже, посвет-лении (хлорозе) зараженного участка. Некроз может быть крупным, достигающим в диаметре нескольких миллиметров, если сигнал от патогена поступает не сразу, а после оккупации им нескольких слоев клеток, или очень мелким, иногда охватывающим лишь первую зараженную клетку (тогда его можно обнаружить только при микроскопировании поперечного среза листа), если реакция на заражение протекает быстро и остро.
СВЧ — одна из форм программированной смерти клеток — апоптоза. Это явление широко распространено в мире животных, растений и микроорганизмов. С помощью СВЧ растения спасают целое ценой гибели части.
генетический контроль ву. СВЧ, как и ВУ, контролируется олигогенами. Таким термином^называют гены, носители которых при расщеплении гибридного потомства отчетливо проявляют фенотипическое отличие от носителей их аллелей. Классические опыты Г. Менделя с окраской цветков и семян гороха основаны на анализе олигогенов. При скрещивании растений устойчивого и восприимчивого к какой-либо болезни сортов гетерозиготное потомство в первом гибридном поколении (F\) будет иметь фенотип одного из родителей — чаще СВЧ, так как ВУ обычно доминирует над восприимчивостью (закон единообразия гибридов Менделя). В F2 произойдет расщепление на два класса — устойчивые (СВЧ) и восприимчивые (спороносящее пятно), по соотношению которых можно определить число генов, контролирующих устойчивость (при наличии одного гена— 3:1, двух — 15: 1 и т.д.). Генетический анализ ВУ может быть осложнен рядом факторов.
• Многие культурные растения являются полиплоидами, содержащими не два, а большее число наборов хромосом. Например, культурный картофель (Solanum tuberosum) — тетраплоид, поэтому ген ВУ к какой-либо болезни может находиться в одном из его четырех геномов (симплексная форма), двух (дуплексная), трех (триплексная) или четырех (квадриплексная). В зависимости от этого цифры расщепления в F2 будут различными и для определения числа генов по соотношению фенотипов у гибридов надо пользоваться справочниками по генетике растений.
• Не всегда просто отнести членов расщепляющейся популяции к устойчивым и восприимчивым классам. Например, разные гены ВУ злаков к ржавчинным грибам имеют неодинаковую экспрессивность (фенотипическое выражение реакции на заражение). Поэтому предложены довольно сложные шкалы учетов таких реакций (рис. 18), которые основаны на соотношении двух показателей — размера пустулы и интенсивности защитной реакции (хлороза или некроза). В показанной на рисунке 18 шкале пять основных типов реакций 0...4 (от хлороза без пустулы до крупной пустулы без хлороза), один смешанный тип (X), при котором реакции разных частей листа не одинаковы, и много дополнительных подтипов. Все типы и подтипы, при которых вокруг места заражения или небольшой пустулы возникает СВЧ (хлороз или некроз), часто объединяют в один фенотипический класс — устойчивость — R (от англ. resistance), а реакции, при которых вокруг крупной или средней величины пустулы нет защитного некроза, — в класс восприимчивость — S (от англ. susceptibility).
• При общих заболеваниях (например, головневых болезнях злаков) учитывают не качественные показатели (СВЧ или спороносящее пятно), а число пораженных растений. Поскольку восприимчивые сорта практически никогда не бывают поражены на 100 %, а устойчивые не остаются абсолютно непораженными, при расщеплении в гибридных семьях те из них, поражение которых не превышает 10 %, относят к устойчивым, а семьи с более высоким процентом поражения — к восприимчивым.

Рис. 18. Шкала учета типов реакции пшеницы на заражение Puccinia graminis
Картирование генов ВУ (определение их расположения на хромосомах относительно других, маркерных генов) привело к паро-доксальным результатам. Оказалось, что они распределены по хромосомам не случайно, а как бы скученно. Причем обнаружены три типа расположения генов ВУ:
• одиночное диаллельное (один локус, контролирующий устойчивость и восприимчивость, с преобладанием доминантного состояния локуса устойчивости);
• одиночное мультиаллельное (один локус со множеством ко-доминантных аллелей, контролирующих устойчивость к разным расам патогена);
• сцепленное, при котором большое число ди- или мультиал-лельных локусов сцеплены и образуют блок фенотипически сходных генов, определяющих устойчивость к одной или нескольким болезням. Такое распределение генов встречается чаще двух первых.
Примеры:
На коротком плече пятой хромосомы ячменя находится изофе-нический блок из пяти локусов, определяющих устойчивость к мучнистой росе; в одном из этих локусов — Mla — картировано около 20 кодоминантных аллелей, определяющих устойчивость к разным расам.
Устойчивость к расам 1, 3, 8 и 10 возбудителя мучнистой росы клевера контролируется аллельными или тесно сцепленными генами.
У льна около 30 генов устойчивости к расам возбудителя ржавчины Melampsora lini расположены в пяти локусах: в локусе L картировано 13 аллельных генов, М—1 тесно сцепленных генов, в локусе Р — 5, N— 3, К— 1.
Устойчивость кукурузы к расам возбудителя ржавчины Puccinia sorgi контролируют пять локусов. Два из них — Rpl и Rp5 тесно сцеплены, причем в первом картировано 14 аллельных и тесно сцепленных генов.
Ген устойчивости риса к бактерии Xanthomonas oryzae Ха21 входит в мультигенное семейство, состоящее, по крайней мере, из восьми членов, которые картированы в одном локусе на хромосоме 11.
Сцепленные гены устойчивости томата к возбудителю оливковой пятнистости Cladosporium fulvum Cfl, С/4, Cf9 расположены на коротком плече хромосомы 1, а С/2 и Cf5— на коротком плече хромосомы 6.
На очень коротком сегменте первой хромосомы ржи расположены гены устойчивости к трем ржавчинам (стеблевой, желтой и бурой). Возможно, это один полифункциональный ген.
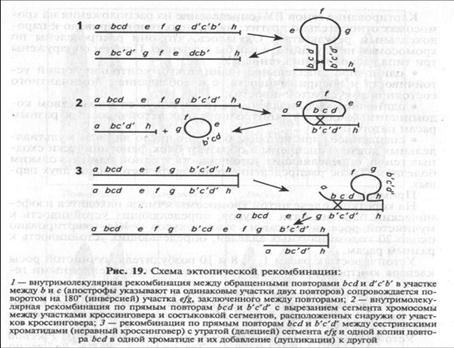
Возникновение кластеров сцепленных генов, функционально и структурно сходных, обусловлено внутри- и межгенными обменами участков ДНК, имеющих прямые (a b с d — a' b'd d') или инвертированные (abed— d' с' b' а') повторяющиеся последовательности, часто приводящими к неравному кроссинговеру (рис. 19).
Наконец обнаружена очень высокая частота мутирования локусов, ответственных за устойчивость, превышающая частоту мутаций других локусов. Например, после облучения у-лучами выявлено 2,8 % мутантов ячменя, устойчивых к мучнистой росе (в контроле — 0,7 %), 2,7 % мутантов льна, устойчивых к ржавчине, 0,1 % мутантов риса, устойчивых к пирикуляриозу.
генетика взаимоотношений с паразитами. Из определения ВУ следует, что гены устойчивости могут обеспечивать непоражае-мость растения одними расами и поражаемость другими. Параллельное изучение генетики устойчивости льна и генетики вирулентности его паразита Melampsora lini привели американского фитопатолога Флора к постулированию концепции, названной им «ген на ген». Результаты классических опытов Флора приведены в таблице 2.
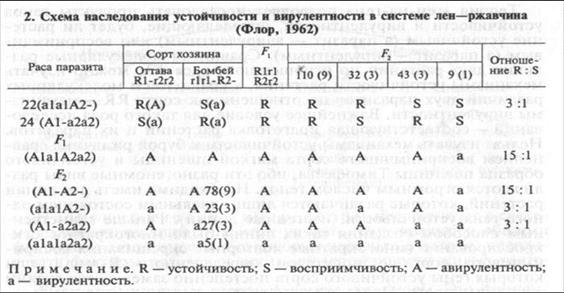
Как видно из данных, представленных в таблице, гетерозиготы хозяина и паразита (F{) соответственно устойчивы к обеим расам и авирулентны к обоим сортам; устойчивость и авирулентность управляются доминантными генами хозяина и паразита. Восприимчивость или вирулентность проявляются при наличии гомозиготных рецессивных аллелей доминантных генов устойчивости и авирулентности. Таким образом, у хозяина и паразита имеются «комплементарные» гены, взаимодействие продуктов которых определяет установление состояния устойчивости или восприимчивости растения к данной расе паразита. Устойчивое состояние возникает лишь в том случае, если взаимодействующие аллели растения и патогена доминантны; если же один взаимодействующий аллель или они оба находятся в гомозиготном рецессивном состоянии, растение восприимчиво. Отсюда следует, что гены вирулентности рецессивны, а гены устойчивости доминантны. Отношения растения и паразита, имеющих по одной паре взаимодействующих генов, можно записать в виде квадратной сетки (табл. 3).
3. Диаллельные взаимоотношения хозяина и паразита в системе «ген на ген»

Теория «ген-на-ген» позволяет исследовать продукты генов устойчивости и вирулентности, определяющие, будет ли растение устойчивым (а паразит — авирулентным) или восприимчивым (а паразит — вирулентным). Сравнивая молекулярные различия двух растений по отношению к расе АА, можно изучать механизмы устойчивости растения, а сравнением молекулярных различий двух паразитов по отношению к сорту RR — механизмы вирулентности. Важнейшее условие для такого рода исследований — соответствующая подготовка растений и их паразитов. Нельзя изучать механизмы устойчивости к бурой ржавчине сравнением восприимчивого сорта мягкой пшеницы и устойчивого образца пшеницы Тимофеева, ибо эти разногеномные виды различаются огромным числом генов. Необходимо иметь две линии растений, которые различаются лишь аллельным состоянием одного гена устойчивости (изогенные линии). Раньше единственным способом создания таких линий было многократное бек-кроссирование (многократные повторные скрещивания восприимчивого сорта с носителем определенного R-гена), при которых гены устойчивого сорта постепенно замещаются генами восприимчивого. После каждого скрещивания необходимо заражение гибридов авирулентной для носителя данного гена расой паразита, чтобы сохранить ген, ради которого производятся скрещивания («не выплеснуть мтаденца вместе с грязной водой»). Работа эта длительная, многолетняя, причем благодаря сцеплению невозможно перенести только один ген в рекуррентный сорт (поэтому такие линии называют почти изогенными). Сейчас благодаря методам работы с рекомбинантной ДНК гены устойчивости многих растений можно клонировать и с помощью генно-инженерных приемов перенести в восприимчивое растение, создав истинно изогенные линии. Для получения изогенных линий паразита (вирулентной и авирулентной) часто авирулент-ный штамм подвергают мутагенной обработке. Поскольку авирулентность доминантна, часто возникающие рецессивные мутации в локусе авирулентности делают паразита вирулентным.
На основании данных, представленных в таблице 3, можно заключить, что продукты генов устойчивости (R-белки) настроены на узнавание выделяемых паразитами химических веществ, которые будут рассмотрены далее.
молекулярные механизмы вирулентности и авирулентности паразитов. Химические продукты, которые паразит выделяет в зараженное растение для установления взаимоотношений с ним, называют иммуномодуляторами. Они могут быть двух типов: супрессоры, или импедины, которые подавляют защитный эффект хозяина, и элиситоры, или индукторы, которые, наоборот, вызывают протекание защитных реакций.
И ммуносу п рессоры. Классификация иммуносупрессоров представлена на следующей схеме.
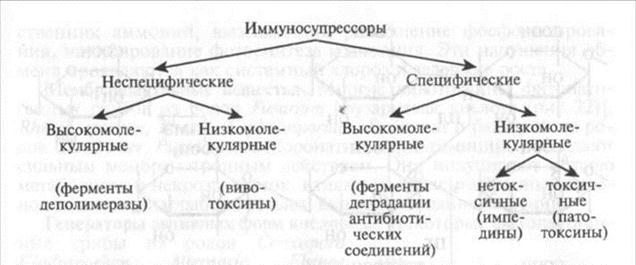
Неспецифические супрессоры не участвуют в системе взаимоотношений типа «ген-на-ген». Они являются общими факторами патогенности, без которых паразит не смог бы преодолевать факторы полевой и истинной устойчивости живых растений.
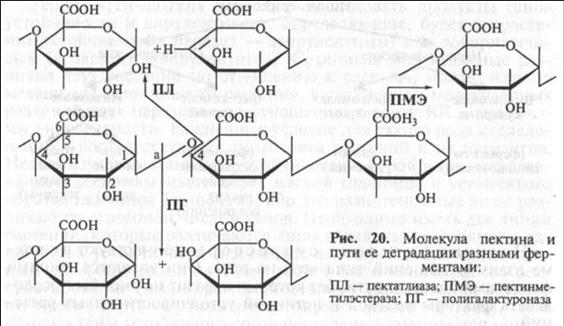
Высокомолекулярные неспецифические супрессоры. Это ферменты, разрушающие клеточные покровы растений. За исключением вирусов, большинство которых «въезжает» в растительную клетку с помощью стилета насекомых, паразиты (грибы и бактерии) должны преодолеть полисахаридный барьер клеточной стенки. Наиболее активны ферменты, вызывающие деградацию пектина, связывающего структурные полисахариды (целлюлозу и гемицеллю-лозу) в единый комплекс и составляющего основу срединной пластинки — межклеточного цемента, объединяющего клетки в ткань. По своей химической природе пектин представляет собой линейную цепь соединенных глюкозидными а-1,4-связями молекул полигалактуроновой кислоты, метилированных по шестому углероду и имеющих редкие веточки, составленные из молекул рамнозы (метилрамнополигалактуронан) (рис. 20). У грибов и бактерий обнаружен набор разнообразных ферментов, разрушающих пектин, — пектиназ. Одни из них (пектинметилэстеразы — ПМЭ) деметилируют молекулу. Свободные карбоксильные группы полигалактуроновой кислоты соединяются с ионами двухвалентных металлов (Са2+, Mg2+) с образованием набухающих в воде пектатов, которые препятствуют ксилемному току и являются одной из причин инфекционного увядания растений. Другие ферменты (полигалактуроназа — ПГ, пектатлиаза — ПЛ) разрезают молекулу полигалактуроновой кислоты на отдельные фрагменты — олигогалактурониды, не способные к связыванию других полисахаридов клеточной стенки. Действие разных пектиназ показано на рисунке 20.
Если биотрофные паразиты, питающиеся содержимым живых клеток, образуют эти ферменты в низких концентрациях, позволяющих сделать в клеточной стенке лишь небольшое отверстие для прохождения инфекционной гифы, то некротрофы снимают оболочку со значительной части клетки. Поскольку клеточная стенка выполняет роль каркаса, поддерживающего протопласт, ее удаление приводит к разрыву содержимого вследствие тургорного давления. Мертвая же клетка не обладает иммунными свойствами и заселяется любыми микроорганизмами, которых она может удовлетворить как источник питания. Мацерация клеток приводит к возникновению сухих (грибных) и мокрых (бактериальных) гнилей.
Низкомолекулярные неспецифические супрессоры. К ним относят вивотоксины — низкомолекулярные метаболиты грибов и бактерий, выделяемые в зараженное растение (in vivo), а не только в искусственную питательную среду, в которой выращивают данный микроорганизм, и вызывающие типичные симптомы болезни (некрозы, увядание).
Токсическое действие вивотоксинов обусловлено их влиянием на разные стороны метаболизма растений. По механизмам токсичности их можно разделить на несколько групп.
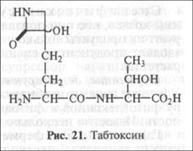
Ингибиторы ферментов растений. Таковы табтоксин фито-патогенной бактерии Pseudomonassyringae pv. tabaci, фазеоло-токсин P. suringae pv. phaseolicola, тентоксин гриба Altemaria altemata. Например, табтоксин — дипептид, соединенный с р-лак-тамовым кольцом (рис. 21). В зараженном растении растительные протеазы отщепляют активную часть токсина табтоксинин-$-лак-там — ингибитор фермента глютаматсинтетазы. Вследствие снижения активности этого фермента накапливается его предшественник аммоний, вызывающий разобщение фосфорилирова-ния, ингибирование фотосинтеза и дыхания. Эти нарушения обмена проявляются как системный хлороз и задержка роста.
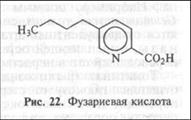
Мембраноактивные вещества. Многие вивотоксины фитопато-генных грибов из родов Fusarium [фузариевая кислота (рис. 22)], Rhinchosporium, Phoma, Cephalosporium, Fusicoccus и бактерий из родов Clavibacter, Pseudomonas (коронатин, сирингомицины) обладают сильным мембранотропным действием. Они индуцируют потерю метаболитов и некрозы клеток, влияют на трансмембранный перенос ионов и ритм работы устьиц, вызывая увядание растений.
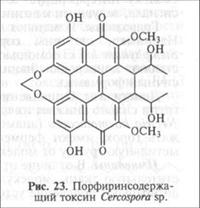
Генераторы активных форм кислорода. Некоторые фитопатогенные грибы из родов Cercospora, Cladosporium, Altemaria, Elsinoe, Hypocrella образуют циклические соединения — пренилированные хиноны (рис. 23), для проявления токсичности которых в отношении растений-хозяев требуется свет, то есть они относятся к группе фотосенсибилизаторов. В результате абсорбции энергии света фотосенсибилизаторы конвертируются в энергетически активное состояние и приобретают способность при взаимодействии с молекулярным кислородом генерировать его активные формы — супероксид-радикал (О2), пероксид водорода (Н202), гидроксил-радикал (ОН-) и синглетный кислород (*02). Все они обладают высокой токсичностью и вызывают повреждения в клетках растений.
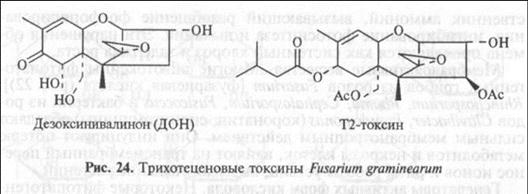
Ингибиторы синтеза белка. Три-хотеценовые токсины фузариевых грибов (рис. 24) ингибируют синтез белка у эукариот. Эти токсины представляют интерес, потому что, во-первых, их продуценты вызывают экономически очень важные болезни пшеницы, ячменя, кукурузы и, во-вторых, содержащие токсины растительные продукты токсичны для людей и сельскохозяйственных животных (вызывают потерю аппетита, дерматиты, анемию, геморрагический сепсис, иммуносупрессию).
Специфические супрессоры определяют крут растений-хозяев, ибо они подавляют защитные реакции или инактиви-руют их продукты только у определенных видов растений, что позволяет продуцентам специфических супрессоров заселять такие растения.
 2013-12-31
2013-12-31 1177
1177
