Различают два основных типа реакций спиртов с участием функциональной группы ОН.
I. Реакции с разрывом О – Н связи
1. Взаимодействие спиртов со щёлочными и щёлочноземельными металлами

Кислотные свойства спиртов выражены слабо. Спирты реагируют с металлами, но не взаимодействуют со щелочами.
2. При действии на спирты органических кислот (в присутствии минеральных кислот) образуются сложные эфиры

3. Спирты окисляются под действием окислителей (дихромата или перманганата калия) до карбонильных соединений:
а) первичные спирты окисляются до альдегидов, которые в свою очередь могут окисляться до карбоновых кислот

б) вторичные спирты окисляются до кетонов

в) третичные спирты окисляются только с разрывом С – С связи

II. Реакции с разрывом С−О связи.
1. Реакция дегидратации:
а) при сильном нагревании (>150 оС)

б) при более слабом нагревании (<150 оС)

2. Обратимо реагируют с галогеноводородными кислотами (проявляют слабые основные свойства)

Многоатомные спирты
Двухатомные спирты (гликоли) содержат в молекуле две гидроксильные группы при разных углеродных атомах.
Первый представитель – этиленгликоль
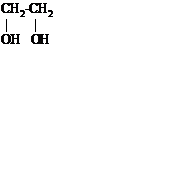
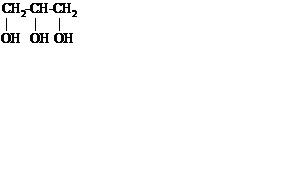
Трёхатомные спирты содержат три гидроксильные группы. Основной представитель – глицерин.
Получение
1. Гидролиз дигалогеналканов

2. Этиленгликоль образуется при окислении этилена водным раствором перманганата калия

3. Гидролизом жиров получают глицерин

Химические свойства
Для двух- и трёхатомных спиртов характерны основные реакции одноатомных спиртов. Взаимное влияние гидроксильных групп проявляется в том, что они более сильные кислоты, чем одноатомные спирты.
Соли двухатомных спиртов называются гликолятами, а соли трёхатомных спиртов – глицератами.
Качественной реакцией на многоатомные спирты, в которых гидроксильные группы находятся при соседних атомах углерода, является ярко-синее окрашивание при взаимодействии их с гидроокисью меди за счет образования комплексного соединения

При нитровании глицерина получается тринитроглицерин

 2018-02-14
2018-02-14 405
405








