L6: Ravimiarendus
1) Sihmärgi defineerimine ja indentifitseerimine, sellele järgneb ravimi disain, mis selle sihtmärgi kaudu toimib.
· Haiguse valik -> ravimi sihtmärgi valik -> biotesti leidmine
· Juhtühend -> selle eraldamine ja puhastamine -> selle struktuuri määramine -> struktuur-aktiivsuse sõltuvus -> farmakofoori kindlaks tegemine –> sihtmärgiga interakteerumise optimeerimine -> farmakokineetiliste omaduste optimeerimine
· Ravimi patenteerimine -> metabolismiuuringud -> prekliinilised katsetused -> tootmisprotsessi väljaarendamine -> kliinilised katsetused -> turustus -> MONEY
2) Sihtmärgi valik
- Retseptorid, ensüümid, nukleiinhapped
- Nõuab põhjalikke teadmisi sellest, millise haiguse faasiga on sihtmärgid seotud
- Tuleb otsustada, kas disainiga agonisti või antagonisti; või keskenduda inhibiitorile
MIDA SUUREM ON RAVIMI SELEKTIIVSUS ÜHE KITSA SIHTMÄRGI SUHTES, SEDA VÄIKSEM ON TÕENÄOSUS INTERAKTSIOONIDEKS TEISTE SIHTMÄRKIDEGA JA SOOVIMATUTEKS KÕRVALNÄHTUDEKS. Kõik ained on mingil määral mürgid, tuleb leida kasu-ohtu võimalikult ideaalset suhet.
N: antimikroobsetest agentidest parimatel ei leidu inimorganismis sihtmärke, küll aga mikroobis. Nt Penitsilliin atakeerib ensüümi, mis osaleb bakteri rakuseina sünteesis, imetajal pole aga ei rakuseina ega vastavat ensüümi, mistõttu penitsilliinil kõrvaltoimed peaaegu puuduvad.
N: isegi kui on sama sihtmärk nii mikroobil kui inimesel, siis miljonite aastate pikkuse evolutsiooni tulemusena on tekkinud neis piisavalt struktuurierinevusi. Need võimaldavad disainida patogeeni-selektiivseid ravimeid. Nt Flukonasool – ravib seenhaigusi, inhibeerides seenes ühe ensüümi – demetülaasi – steroidide biosünteesirajal. Inimese ensüümi aga ei mõjuta.
RAVIM PEAB OLEMA SPETSIIFILINE KA INIMORGANISMILE MÕJUTAVATELE ENSÜÜMIDE SUHTES. TÄNAPÄEVANE RAVIM PEAB OMAMA SELEKTIIVSUST KA SIHTMÄRK ENSÜÜMI ISOVORMIDE SUHTES.
Samuti võimaldab kõrge spetsiifilisus retseptori kindlale tüübile saavutada selektiivsust organite või organi osade suhtes, kuna retseptori alatüübid pole ekspresseeritud ühtlaselt kogu organismi ulatuses, olles kontsentreeritud teatud kudedes/rakutüüpides. Seega on võimalik luua ravimeid, mis nt toimivad kopsudes, kuid ei oma kõrvaltoimeid südamele ega vice versa.
Samuti aitab retseptori alatüübile spetsiifiline ravim vältida olukorda, kus normaalselt lühikese elueaga neurotransmitteri analoog toimiks signaaliülekandjana kogu organismile – põhjustades kõrvalmõjusid – vaid ainult ühes aju piirkonnas nagu nt Parkinsoni tõve puhul, kus on lokaalselt häiritud dopamiini ülekanne.
REEGLINA OSALEB ÜHES PROTSESSIS ROHKEM KUI ÜKS ENSÜÜM VÕI RETSEPTOR. Hõlmatud on terve rida signaalmolekule, retseptoreid ja ensüüme.
N: kõrgvererõhutõve e hüpertoonia puhul on lai valik ravimisihtmärke – kasuatatakse seetõttu kombineeritud preparaate.
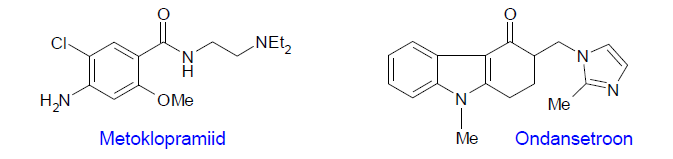
N: Iiveldusvastane ravim metoklopramiid, D2-antagonist. Sellest tugevamad antagonistid ei toimi, mistõttu avastati uus sihtmärk – serotoniini retseptor (enne oli dopamiini), millele disainiti uued iiveldusvastased ravimid, antagonistid nagu nt ondansetroon:
3) Biotest: peab olema lihtne, kiire, usaldusväärne; esmalt in vitro testid (spets koed, rakud, ensüümid ning inhibiitoreid katsetatakse puhastatud ensüümide lahuses) ja siis in vivo loomkatsed.
In vitro testis mõõdetakse ravimi füsioloogilist efekti.
N: bronddilaatorite aktiivsuse hindamine isoleeritud trahhea silalihaste kontraksioonide inhibeerimise kaudu.
N: antikoagulante hinnatakse isoleeritud vereliistakutel
N: retseptori ant/agoniste hinnatakse isoleeritud kudedel või rakukultuurides, mis sihtmärk-retseptorit oma pinnal ekspresseerivad.
MOLEKULAARGENEETIKA: ENSÜÜM VÕI RETSEPTORIT KODEERIV GEEN TUVASTATAKSE, KLONEERITAKSE JA EKSPRESSEERITAKSE KIIRE POOLDUMISEGA KULTUURIS NAGU NT BAKTERID, PÄRMID, KASVAJARAKUD.
In vivo testis kutsutakse loomal esile haigusesümptomid (põletik) ja jälgitakse ravimi efektiivsust selle kõrvaldamisel.
Sageli transgeensetel loomadel. Nt hiire geenide asendamine inimese omadega; hiires sünteesitakse seeläbi inimese ensüüme ja retseptoreid. Või pannakse hiir haigestuma inimese haigusesse, geneetiliselt – rinnavähk. Seejärel testitakse ravimeid
Sellegipoolest võivad kõrge efektiivsusega ravimid loomkatsetes võivad osutuda ebaefektiivseteks kliinilistes katsetes. Seetõttu on mõttekas teha katseid eri liikidel.
Skriiningu tüübid:
HT skriining (high troughput) – 1000-te ühendite automatiseeritud testimine mitmekümnel erineval sihtmärgil gen.modifitseeritud rakkudes. Eeldab kergesti mõõdetavat efekti, mida saab automaatselt registreerida.
N: raku kasv, värvireaktsiooniga ensüümkat, radioligandi retseptorite sidumise inhibeerimine
TMR skriining – uuritav ühend viiakse lühida energiaimpulsi andmisel ergastatud olek usse. Aatomite tuumad annavad aeglaselt ära saadud energia, minnes tagasi lähteolekusse. Seda saab registreerida TMR spektrina. Relaktsiooniaeg sõltub molekuli suurus est, olles suurematel lühike ja madalmolekulaarsetel pikk. Emissiooni regamist saab viivitada detekteerides vaid väikesi molekule. Nii saab mõõta keerulisi segusid, sünteesi produkte jne. Seostumsit valguga.
Teisi viise – afiinsus, SPR- ja stsintillatsioon-skriining.
4) Juhtühendi leidmine: võib olla kaugem ideaalist, madala aktiivsuse ja sobimatute kõrvalefektidega, kuid ta on vajalik lähtepunkt ravimidisainile ja tootearendusele.
Allikad:
- looduslike ühendite skriining,
- meditsiiniline folkloor,
- sünteetiliste pankade skriining,
- olemasolevad ravimid,
- looduslikud ligandid/modulaatorid,
- kombinatoorne süntees (he apeptiidravimite puhul)
- kompuuteriseeritud disain,
- juhus ja intuitsioon,
- arvutiotsing andmebaasidest,
- TMR-disain (saab vaadata fragmenti kaupa, mis kuhu seondub ja lõppuks saada terve pilti kompleksist)
Looduslike ühendite skriining: ammendamatu allikas. Liigne keerukus, liiga madal sisaldus looduslikes objektides. Tõeline nuss on eraldada neid aineid arvestatavas koguses (artemisiniin-malaaria ravim, taksoon-vähiravim)
Taimed – lõputu ühendirikkus, leidmistõenäosus on suur. Toksilisi ühendeid sisaldavatel taimedel on suurem tõenäosus ellu jääda – loodusepoolne skriining.
Mikroobid – antibakteriaalsed ühendid – penitsilliin, tetratsükliin, aminoglükosiidid jt
Mereelukad – korallid, käsnad, igasugused vetikad – erinevad metaboliidid, eikosanoidid, steroidid, terpenoidid – paljud pakuvad farmatseutilist huvi.
Loomad – Not a very good source. Mõnest mürgisest konnaliigist on saadud antibakteriaalseid agente ja valuvaigisteid.
Ussimürgid – toksilised polüpeptiidid; kõrge spetsiifilisus teatud retseptorite suhtes.
Puhastamine – probleem seisneb selles, et looduslikus ühendites on palju erinevaid komponente, mis on raske teine teisest eraldada. Populaarsem on kromatograafiline meetod.
Struktuuri määramine – TMR, MS, IR
Struktuur-aktiivsus – struktuurielemendid, mis on olulised interaktsioonides sihtmärk-molekuliga. Sünteesitakse sarnaseid ühendeid ning testitakse nende aktiivsusi. See ongi struktuur-aktiivsus uuring.
| Lähtef-n | Sideme tüüp sihtmärgiga | Moditud vorm |
| OH-rühmad | Vesiniksidemed | R-O-R, R-O-O-R |
| Aminogupid | H- ja ioonsed sidemed | Amiidid |
| Aromaatsed tsüklid | Van der Vaals | Tsükloalkaanid |
| = kaksiksidemed | Van der Vaals | Küllastatud ühendid |
| Ketoonid | H-sidemed | Alkohol |
| Amiidid | H-sidemed | Amiinid |
5) FARMAKOFOORI KINDLAKS MÄÄRAMINE – järgmine etapp uuringutes.
Summeerib ravimi aktiivsuseks vajalikud funktsionaalsed grupid ja nende ruumilise paiknemise üksteise suhtes. Kui ükski ravim pole ideaalne, tuleks otsida vähemalt optimumi.
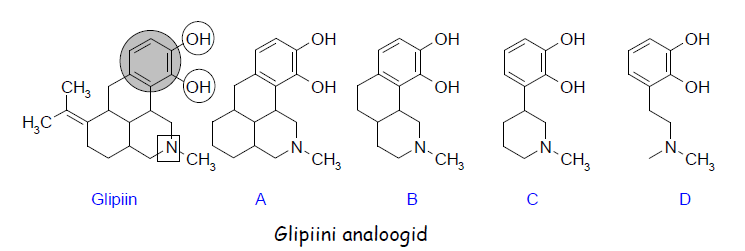
N: hüpoteetiline ravim, glipiin.
Neli eesmärki, mis ravimit arendades tuleb meeles pidada:
- kõrge aktiivsus
- vähesed kõrvaltoimed
- manustamise lihtsus ja efektiivsus
- sünteesi lihtsus
Mida tugevamini interakteerub sihtmärgiga, seda efektiivsem madalama doosi juures. Sealjuures peaks ravim olema kõrgema selektiivsusega (vähem kõrvaltoimeid).
Farmakokineetika – hea ravim on piisavalt stabiilne, et jõuda sihtmärgini ja piisavalt labiilne, et alluda metabolismile ja organismist täielikult väljuda peale oma regulatoorse ülesande täitmist.
Tihti aga on palju molekulaarseid barjääre, takistusi või ravim ei jõuagi sihtmärgini, mistõttu ei jõua see oma molekulaarse sihtmärgini.
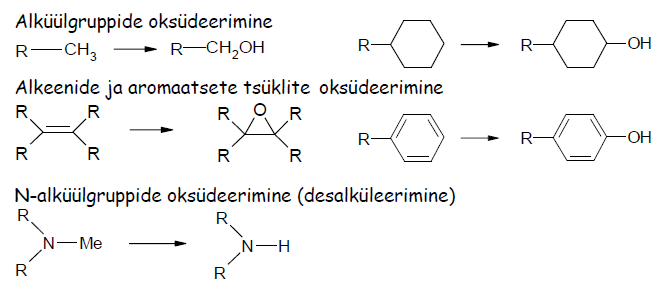
6) Ravimi metabolism – toimub atakk metaboolsete ensüümide poolt, mille ülesanne on võõrained modifitseeridada vormi, kus nad on organismist eritatavad (olles sel juhul metaboliidid). Metabolism jaguneb kaheks faasiks: I ja II.
I faasi reaktsioonid:
Oksüdeerimine tsütokroom P450 ensüümidega:
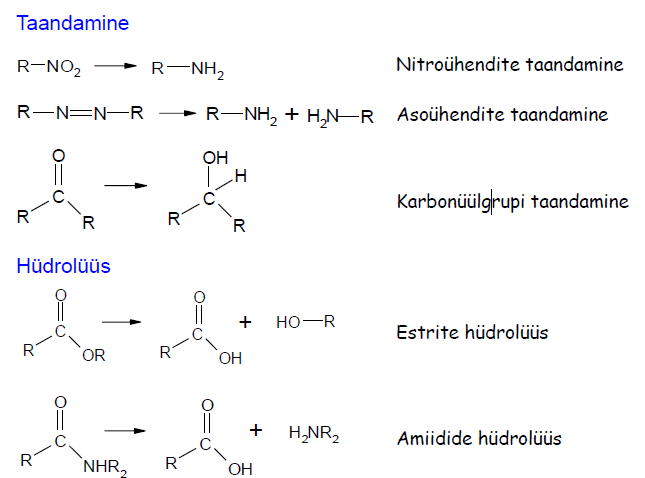
II faasi reaktsioonid: t oimuvad peamiselt maksas erinevate transferaaside toimel. Konjugatsioonireaktsioonid. Ravimi polaarne molekul seob veel polaarsema molekuli. Kojugaat, mis tekib, on piisavalt polaarne, et tagada enda kiire eritamine uriini või sapi kaudu.
Konjugaate:
- Glükouroniidid
- Sulfaat-konjugaadid
- Glutatioon-konjugaadid
Samuti toimuvad faas II-s reaktsioonid, mis polaarsust vähendavad.
- Metüülimine (fenüülide, amiinide ja tioolide metüleerimine S-adenosüülmetioniiniga)
- Atsetüülimine (primaarsete amiinide Ac-CoA-ga)
Tootmine: peab olema efektiivne ja ökonoomne.
Kiraalsus – ratsemaati on lihtne sünteesida, kuid tihti peab aine olema enantiomeerselt puhas eriti, kui neil on erinev aktiivsus.
N: UH-301, mis rac-na on inaktiivne, kuid puhtad enantiomeerid on vastupidise aktiivsusega; üks on agonist, teine aga antagonist, mis serotoniini retseptorile mõjumist puudutab.
- Puhastamine
- Asümmeetriline süntees
o Tihti mõistlikum vähendada kiraalsete tsentrite arvu
o C asendamine N-ga, misjuhul muutub akiraalseks.
7) Prekliinilised katsetused – transgeensed hiired, kantserogeensus. LD50 doos, mille puhul 50% katseloomadest sureb. Siiski ei kirjelda see mitteletaalset mürgitust ega kroonilist mürgitust.
8) Kliinilistekatsetustefaasid:
I faas – terved vabatahtlikud
II faas – vähestel patsientidel, terapeutilise efekti kontrolliks, samuti annustamisrežiim doosi suuruse leidmiseks
III faas – platsebo kontrolliga topelt pime metoodika. Nii arstid kui patsiendid on teadmutuses, kas võetakse ravimit või platsebot. Antakse müügiluba.
IV faas – Ravitulemuste hoolikas dokumenteerimine ja edasine patsientide jälgimine. Tõsiste kõrvalefektide ilmnemine üksikutel patsientidel.
I – III faasis on vajalik patsiendi nõusolek, aga kui patsient pole võimeline seda andma (vaimuhaiged, lapsed).
Patenteerimine – ei tohi olla avalikustatud enne.
L7: Ravimidisain ja ravimi-sihtmärgi interaktsioon
1) Milliseid võtteid kasutatakse ravim-sihtmärk interaktsioonide optimeerimiseks?
Asendusrühmade varieerimist (nt alküülrühmade asendamist),
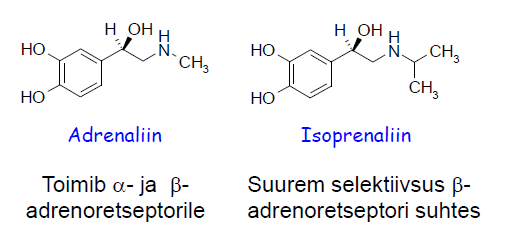
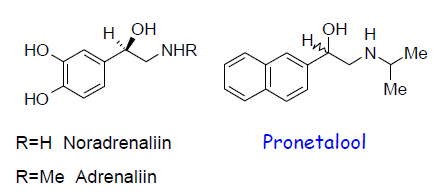
CH3-, CH3CH2-, CH3CH2CH2- jt kasutatakse ajela pikkuse ja sidumise mahu uurimiseks. Raske vahetada.Suurem maht võib tähendada suuremat selektiivsust retseptori suhtes (täidab tasku nt), väiksemad kõrvalnähud. Nt Adrenaliin vs Isoprenaliin.
Ahelate pikendamist või lühendamist
Võib viia parema sidumise läbi suurema aktiivsuseni.
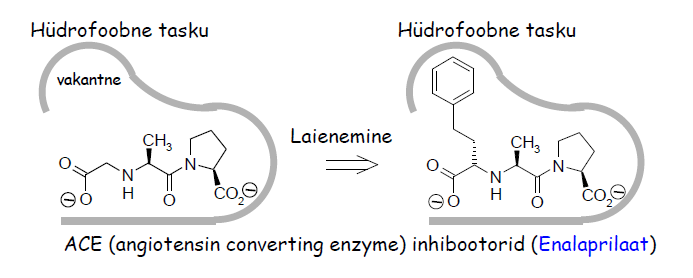
Struktuuri laiendamist (täiendavad rühmad, seeläbi ka täiendav sidumine sihtmärgiga),
Hüdrofoobsuse otsimiseks - alküülrühmade liitimine alkoholidele, fenoolidele, amiinidele, karboksüülhapetele.
Vesiniksidemete ja iooniliste interaktsioonide saamiseks lisatakse alkohole, amiine.
Nt vererõhualandaja etüülfenüül, 1000x aktiivsuse tõus fenüülrühma sidumisega.
Kasutatakse agonisti antagonistiks muutmisel (sidumispiirkondade olemasolu, mis looduslikul agonistil/substraadil on puudu. Sidumise aktiivsuse tõttu muutubki ühendi olemus antagonistiks agonistist).
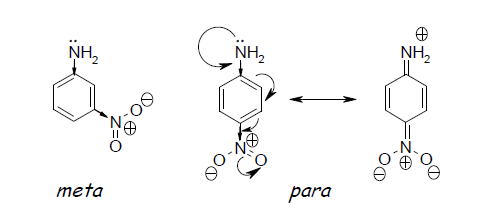
Varieerimine aromaatse tuuma asendajate puhul (aktiivsuse suurenemine, rühma asukoha muutus),
Suhteliselt lihtne, nt OH-rühm para või meta asendis on erineva mõjuga, lastes meta asendis paremini H-sidemeid moodustada st ühend on aktiivsem.Muutes ühte asendajat, võivad muutuda teise asendaja omadused ja seeläbi ka kogu ravimi omadused.
Eneg NO2 vähendab NH2 aluselisust para asendis rohkem kui meta asendis (vähendab võimet seostuda retseptori/ensüümi ioonsete sidumispiirkondadega, väiksem aktiivsus). Proovi erinevaid.
Tsüklite laiendamine või vähendamine (muudab siduvate gruppide asendit, sidumise tugevust),
Muudab siduvate gruppide asendit ja sidumise tugevust. Sarnane aromaatse tuuma asendajate asukoha muutustega.
Tsüklite varieerimine (kahe N asemel 3 N heterotsüklis nt)
Seenevastane, imidasooli asendamine 1,2,4-triasooliga muudab ravimi inimese ensüümi suhtes inaktiivseks. Seene ensüümi aga inhibeerib. Samuti patentidest mööda hiilimiseks. COX-i inhibiitorid ka.

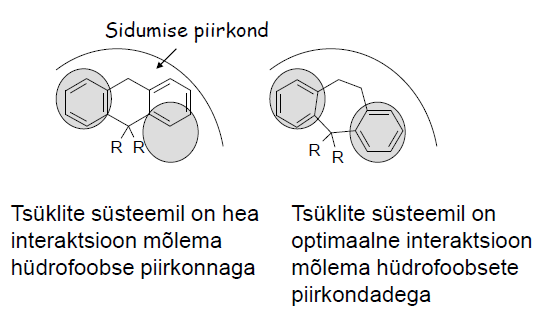
Tsüklite liitmine (benseeni asemel naftaleen).
VB parem sidumine ja suurem selektiivsus. Adrenaliini retseptorile selektiivne, benseeni asemel naftaleeniga molekul, pronetalool. Selektiive β-retseptorile kuna: α-retseptor liiga väike naftaleeni jaoks, β-retseptoril suurem van der Waalsi sidumisala kui α-retseptoril.
Asendajate varieerimine
OH ja Ph-OH - vesiniksidemed
Benseeniring - van der Waals
= - van der Waals, väiksemamõõtmeline kui aromaatne ring.
RCOR ja RCOH - vesiniksidemed, karbonüüli hapnik on H-aktseptor
NH2 - vesiniksideme aktseptor H, doonor N. Tertsiaarse amiini ioniseerumine
RCONH2 - amiidid, vesinikside, peptiidsideme analoogia, amiini analoog.
NR4+ soolad - ioniseerunud sideme teke karboksülaatgrupi või indutseeritud dipoolinteraktsioon kvat. ammooniumi soola ja aromaatse ringiga.
COOH - H-doonor/aktseptor, võib esineda karboksülaatioonina
COOR - karbonüülrühma hapnik H-doonor, esteraasid hüdrolüüsivad, eelravimite oluline komponent, karboksüülhappe analoogid.
Heterotsüklid - N, van der Waals, H-sidemed
3) Külgahelate muutmine
Struktuuri lihtsustamine etapiti, lähtudes looduslikest ühenditest. Vältida tuleb omaduste muutust ja kõrvalefekte.
Nt kokaiin -> provokaiin (novokaiin), kus on lõhutud alkaloidi tsükkel ja asendatud dietüülamiiniga. Ilma kõrvalmõjudeta.
Struktuuri jäigastamine - konformatsioonide hulk väiksem ning vähendab seondumist teisele võimalikule retseptorile (kuna sobivat retseptorit ei pruugi leiduda). Kolmikside, amiidrühm, aromaatne tsükkel.
Blokaatorid - vähendavad konformatsioonide arvu ja aitavad jäigastada.
Nt Me rühma sidumine D3 antagonistile viib fenüülrühma nurga alla, kuid seondumiseks peab olema kaks tasapinnalist fenüülrühma, mistõttu seondub ühend D3 retseptorile halvemini.
4) Manipulatsioonid tsüklitega
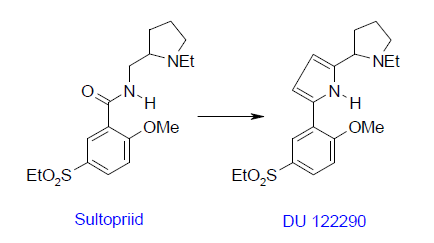
Amiidi asendamine pürrooliga nt dopamiini D3 retseptori suhtes selektiivsuse tõstmiseks vähendab kõrvalefekte, mis tulevad D2 retseptorile toimimisest (parkinsons).
Provokaiinid/novokaiinis on kokaiini tritsükkel asendatud kahe dietüülamiiniga, andes kõrvalmõjudeta kohaliku tuimesti.
Mis on isosteerid?
Omadused erinevad, kuid suurus, polaarsus, elektronide jaotus on sama.
Nt: Fluor on Süsiniku isosteer, kuna neil on
· sarnased mõõtmed
· teised omadused
o C-F side on stabiilsem kui C-H side.
Nt Amiidi asendamine pürrooliga, selektiivsem D3 suhtes, ja ei seondu D2-le (kõrvalefektid). Antipsühhootilise ravim.
Valgu (ensüümi substraadi või inhibiitori ning retseptori ligandi sidumistsentri) struktuurist lähtuv ravimidisain
Ensüümi substraat või inhibiitor: ACE inhibiitorit vaja, blokkida angiotensiin II süntees, mis kutsub esile vererõhu tõusu.Inhibiitor annab vajalikud sidemed aktiivtsentriga. Peptiidside aga puudub ja ensüüm jääb inhibeerituks, kuni inhibiitor asub aktiivtsentris.
Aktiivtsentris sisalduvad Zn2+ aatom ja arginiin;Eeldati, et inhibiitoris peaks olema suktsiinhappe element;Vastavalt ensümaatilisele reaktsioonile eeldati, et inhibiitor peaks sisaldama aminohapet;
Suktsinüül proliin valiti kuna ACE teadaolevas inhibiitoris – teprotiidis on terminaalne aminohape proliin ja suktsiinhappe derivaat oli analoogse ensüümi - karboksüpeptidaasi inhibiitor.Suktsinüül proliin omas tõepoolest inhibeerivat toimet. Seega eeldati, et tekkinud karboksülaatioonid on seotud nii tsingi iooni kui ka arginiiniga.Eeldati ka, et aktiivtsentris on olemas ruum aminohapete kõrvalahelate mahutamiseks.Asuti otsima rühma, mis suurendaks inhibiitori sidumist aktiivtsentrisse.Sobiv oli metüülrühm. Aktiivsus suurenes.Asuti otsima karboksülaat ioonist sobivamat rühma Zn2+ sidumiseks.SH-rühm tõstis täiendavalt aktiivsust. Kaptopriil – esimene mittepeptiidne ACE inhibiitor ravimiturul.Fenüülrühma lisamise tulemuseks on suurema aktiivsusega ACE inhibiitor - enalaprilaat. 1000x vähem vaja sisse süüa, 1000x efektiivsem, vähem kõrvalmõjusid. Vaba happena ei töötanud, estrina töötas.

 2018-02-20
2018-02-20 854
854







