Соли, образованные катионами слабого основания и анионами слабой кислоты (NH4CN, CH3COONH4, (NH4)2S, (NH4)2CO3 и др.).
Соли этого типа за счет гидролиза в водных растворах имеют слабокислую, слабощелочную или нейтральную реакцию в зависимости от величины констант диссоциации кислот и оснований, образующих данную соль. Гидролиз идет по катиону и аниону одновременно.
29. Степень окисления. Определить степень окисления серы в соединениях: S+4O2-2, H2+S-2, Na2+S+6O3-2, S80, Fe2+3(S+6O4-2)3-2.
30. Степень окисления. Определить степень окисления хрома в соединениях: H2+Cr-6O4-2, Cr+2Cl2-, Cr2+3O3-2, Na3[Cr(OH)6], (NH4)2Cr2O7;
31. Степень окисления. Определить степень окисления азота в соединениях: Ba(NO3)2, NH3, N2, KNO2, N2O4.
Окислители и восстановители. Приведите примеры.
О-в реакции – протекают и изменением степени окисления элемента.
2H2S-2 +3O2 = 2S4O2+ 2H2O
Повышение степени окисления в ходе реакции, отвечающей потере (отдаче) электронов атомами элемента, называют окислением:
S-II - 6e− = SIV
В данном примере окисляется S−II до SIV.
Понижение степени окисления элемента в ходе реакции, отвечающее присоединению ("взятию") электронов атомами этого элемента, называется восстановлением:
O0 + 2e− = O−II
Закон Рауля. Давление насыщенного пара над растворителем и раствором.
Закон Рауля:
Относительное понижение давления пара растворителя над раствором нелетучего неэлектролита равно мольной доле растворенного вещества:
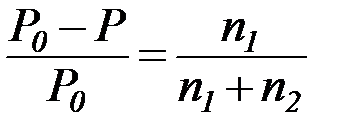 , ,
| (1) |
где Р – давление насыщенного пара растворителя над раствором
(атм; Па; мм. рт. ст.);
Р0 – давление насыщенного пара над чистым растворителем
(атм; Па; мм. рт. ст.);
n1 – количество растворенного вещества (моль);
n2 – количество растворителя (моль).
Насыщенный пар - пар, находящийся в динамическом равновесии со своей жидкостью.
Насыщенный пар характеризуется давлением P (Па, атм), которое иногда называют упругостью пара. Давление насыщенного пара зависит от природы жидкости и от температуры. С ростом температуры давление насыщенного пара возрастает.
Относительное понижение давления пара растворителя над раствором нелетучего неэлектролита равно мольной доле растворенного вещества:
1) где Р – давление насыщенного пара растворителя над раствором (атм; Па; мм. рт. ст.);
2) Р0 – давление насыщенного пара над чистым растворителем (атм; Па; мм. рт. ст.);
n1 – количество растворенного вещества (моль);
n2 – количество растворителя (моль).
 2020-01-15
2020-01-15 136
136








