На диаграмме состояния (рис. 7). только высший оксид  (гематит) представлен вертикалью, характерной для соединений постоянного состава. Оксиды
(гематит) представлен вертикалью, характерной для соединений постоянного состава. Оксиды  и FeO имеют области гомогенности, то есть являются соединениями переменного состава. Эти фазы называются магнетитом и вюститом. Они имеют повышенное по сравнению со стехиометрией оксидов содержание кислорода.
и FeO имеют области гомогенности, то есть являются соединениями переменного состава. Эти фазы называются магнетитом и вюститом. Они имеют повышенное по сравнению со стехиометрией оксидов содержание кислорода.
С термодинамической точки зрения нестехиометричность оксидов  и
и 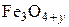 можно трактовать как образование твердых растворов
можно трактовать как образование твердых растворов  в
в 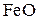 и
и  в
в  . Условия существования (состав–температура) только этих гомогенных растворов и в гетерогенной смеси их с другими фазами соответствуют определенным областям ненасыщенных растворов (IX и XV) и областям X, XII, XII, XIII, XVII насыщенных растворов на диаграмме состояния (см. рис. 7).
. Условия существования (состав–температура) только этих гомогенных растворов и в гетерогенной смеси их с другими фазами соответствуют определенным областям ненасыщенных растворов (IX и XV) и областям X, XII, XII, XIII, XVII насыщенных растворов на диаграмме состояния (см. рис. 7).
В упрощенной записи (без указаний на изменения состава фаз) схемы превращений могут быть представлены в виде:
 →
→ 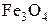 → Fe при
→ Fe при 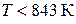 (570 °С);
(570 °С);
 →
→ 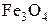 → FeО → Fe при
→ FeО → Fe при  (570 °С).
(570 °С).
Эти схемы соответствуют общему принципу последовательности превращений А.А. Байкова от высшего оксида к металлу через все устойчивые более низшие оксиды.
Согласно этим упрощенным схемам уравнения реакций диссоциации часто записывают как взаимодействия стехиометрических соединений (постоянного состава)

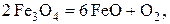

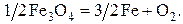
Более строго, с учетом растворимости оксидов и образования растворов кислорода в твердом Fe (область I), уравнения реакций диссоциации можно записать в виде:

| (область XVII) | (27) |

| (область XV) | (28) |

| (область XII) | (29) |

| (область IX) | (30) |

| (область X) | (31) |

| (область XIII) | (32) |

Рис. 7. Диаграмма состояния системы железо–кислород:
А – 1808 К, 0% IX – вюстит FeO1+ x
В – 1790 К, 0,16% X – Feg(O) + FeO1+ x ¢
Е – 1643 К, 23,16% (~FeO1,052) XI – Fea(O) + FeO1+ x ¢
H – 1697 К, 25,60% (~FeO1,16) XIII – Fea(O) + Fе3O4
К – 1870 К, 27,64% (Fe3O4) XIV – Fe3O4+ y + оксидный расплав
M – 1730 К, 28,36% (~Fe3O4,145) XV – магнетит Fe3O4+ y
N – 1730 К, 30,06% (Fe2O3) XVI – Fe3O4+ y + O2
I – условная область твердых растворов XVII – Fe3O4+ y + Fe2O3
кислорода в d, g и a-железе XVIII – гематит Fe2O3 + O2
II – растворы кислорода в жидком Fe
III – Feж(O) + оксидный расплав
IV – оксидный расплав
V – оксидный расплав + О2
VI – Fed(O) + оксидный расплав
VII – Feg(O) + оксидный расплав
VIII – вюстит + оксидный расплав
В уравнениях (2.27), (2.29), (2.31) и (2.32) оксиды записаны как фазы (насыщенные растворы); в уравнениях (2.28) и (2.30) оксиды рассматриваются как компоненты ненасыщенных растворов магнетита и вюстита.
Для анализа равновесий в системе на диаграмму состояния нанесены вспомогательные линии при 3 температурах 773, 1273 и ~1600 К и отмечены точки фазовых превращений (а, b,  и т.д.).
и т.д.).
Рассмотрим систему, описываемую уравнением (10). Константа равновесия реакции равна
 .
.
В области XII существования насыщенных растворов магнетита и вюстита при  активности компонентов неизменны. Если принять отношение активностей равным единице, то
активности компонентов неизменны. Если принять отношение активностей равным единице, то  при
при 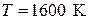 В области IX существования вюстита по мере диссоциации
В области IX существования вюстита по мере диссоциации 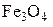 концентрация FeO, а, следовательно, и активность FeO в вюстите увеличивается. Значит, упругость диссоциации вюстита уменьшается
концентрация FeO, а, следовательно, и активность FeO в вюстите увеличивается. Значит, упругость диссоциации вюстита уменьшается  при
при  . Увеличение содержания FeO в вюстите при уменьшении концентрации
. Увеличение содержания FeO в вюстите при уменьшении концентрации  в нем соответствует уменьшению % О в растворе при переходе от точки d к точке c для
в нем соответствует уменьшению % О в растворе при переходе от точки d к точке c для  . Таким образом, по мере диссоциации
. Таким образом, по мере диссоциации
|
 при
при  в приближении равенства единице отношения активностей FeO и Fe в насыщенных растворах.
в приближении равенства единице отношения активностей FeO и Fe в насыщенных растворах.
Аналогично можно проанализировать равновесия (27) и (32) и, дополнив анализ теоретическим положением об уменьшении равновесного давления кислорода над раствором кислорода в Fe по мере перехода к чистому железу, построить изотермы упругости диссоциации оксидов железа (рис. 8).

Рис. 8. Изотермы упругости диссоциации оксидов железа
На рис. 8 линии наклонных участков проведены приближенно, так как для точного построения необходимы расчеты на основе данных об активностях компонентов растворов. Точки перелома взяты с диаграммы состояния системы Fe – O. Значения упругости диссоциации оксидов в моновариантных системах соответствуют расчетным величинам рис.4.
Таким образом, изотерма упругости диссоциации последовательно распадающихся и образующих растворы соединений состоит из чередующихся горизонтальных и наклонных участков.
По мере диссоциации, в конечном счете, идет упрочнение фаз. Для получения чистого металла необходимо полностью удалять из газовой фазы кислород.
 2020-01-14
2020-01-14 300
300








